
题目列表(包括答案和解析)
25、将10g铁粉置于40mlHNO3溶液中,微热,反应过程中随着HNO3浓度的降低生成气体的颜色由红棕色变为无色(只考虑NO)。充分反应后,溶液中还残留4.4g固体,且产生的混合气体恰好可用100ml 1.5mol·L-1的NaOH溶液处理完全。
(1)求该反应中被还原和未被还原的HNO3的物质的量之比。
(2)求原HNO3溶液物质的量浓度。
24、利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。


(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同) 。
(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 ,
反应 (填“放出”或“吸收”) 热量。(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是 (填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体原子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1_________,E2________,
 E3 (填“增大”“减小”或“不变”)。
E3 (填“增大”“减小”或“不变”)。
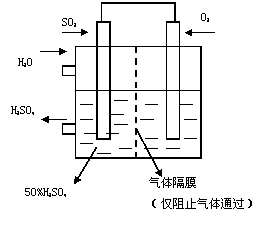
(5)若以右图所示装置,用电化学原理生产硫酸,将SO2
、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式: ,
。
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入
SO2和水的质量比为 。
(6) SOCl2是一种无色液体,可与碳共同构成锂电池的正极
材料,且其放电时也有SO2气体产生。写出
SOCl2在电池中放电时的电极反应式 。
23、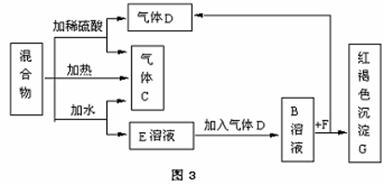 由A、B两种常见化合物按物质的量之比为1∶2组成混合物,其相互关系如图。已知A、B的焰色反应均呈黄色,
由A、B两种常见化合物按物质的量之比为1∶2组成混合物,其相互关系如图。已知A、B的焰色反应均呈黄色,
C、D为两种常见的对大气无污染
性的无色气体,但D能导致“温
室效应”,F遇硫氰化钾溶液呈红色。
根据以上条件回答下列问题:
(1)E的化学式 A的电子式
(2)A物质与水反应的化学方程式
(3)A、B按上述物质的量之比加热反应的化学方程式
(4)B溶液与稀硫酸反应的离子方程式为
(5)B溶液与F溶液反应的离子方程式为
22、现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)写出C2A4的电子式 。C2A4 的水溶液呈 (填“酸”“碱”或“中”)性,1mol C2A4最多可以与 mol HCl或NaOH发生中和反应生成正盐。C2A4 和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4 和A2D2 既具有氧化性又具有还原性的原因 。
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:
,该化合物与CA3和A2D的熔点由高到低的顺序为 (用化学式表示)。
(3)燃料电池是一种新型电池。由A、B、D组成的一种日常生活中最常见的有机物与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视。写出负极的电极反应式: 。
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃,写出该同素异形体的结构式 。CA3、A2D、EA3的热稳定性由强到弱的顺序为 (用化学式表示)。
翰林汇
21、图表法、图象法是常用的科学研究方法。
(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量。从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推。
现有5种元素L、M、N、O、P,其I1-I3分别如下表,根据表中数据判断其中的金属元素有 ,稀有气体元素是 ,最活泼的金属是 ,显二价的金属是 。
|
元 素 |
I1/eV |
I2/eV |
I3/eV |
|
L |
13.0 |
23.9 |
40.0 |
|
M |
4.3 |
31.9 |
47.8 |
|
N |
5.7 |
47.4 |
71.8 |
|
O |
7.7 |
15.1 |
80.3 |
|
P |
21.6 |
41.1 |
65.2 |

(Ⅱ)某温度时,在一个5L的密闭容器中,M、P、Q三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的 倍;从反应开始到平衡气体M的平均反应速率为
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是 。
20、在常温、常压下R为气体单质,B、M为固体单质,A、C、D、E、F、H为化合物,A、C为气体,它们之间的相互转换关系如下图所示(反应所需条件未注明,某些反应已将水等次要产物略去)
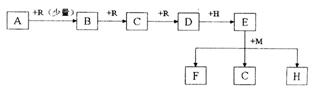
请回答下列问题:
(1)实验室快速制取少量R的方程式为 ,发生装置可以选取下列装置中的 (填字母)



(a) (b) (c)
(2)若F溶于水得到蓝色溶液,则M为 ,E与M反应的化学方程式为 ,取50ml物质的量浓度为18mol·L-1的E溶液与足量的M在加热条件下充分反应,得到气体C在标准状况下的体积为V L,下列说法中正确的是:
(A)V <10.08
(B)因为M为足量,可以计算出被还原的E的物质的量为0.45 mol
(C)被氧化的M的质量为 g
g
(D)若将生成的气体C通入紫色石蕊试液中,溶液先变红,最终褪为无色。
(E)可以用BaCl2溶液来检验最终溶液中E有无剩余。
(3)若M为短周期元素形成的黑色固体单质,实验室利用下图装置检验E和M在加热条件下反应所得全部产物。

①装置甲中应加的试剂是 ;
②装置乙、丙和丁中所加试剂分别是 (填下列选项的字母序号)
(A)澄清石灰水、品红溶液、高锰酸钾酸性溶液
(B)品红溶液、高锰酸钾酸性溶液、澄清石灰水
(C)澄清石灰水、高锰酸钾酸性溶液、品红溶液
③在实验中如果将丙去掉, (填“能”或“不能”)达到实验目的,原因是 。
④如果将烧瓶中产生的气体混合物分别通入Ba(NO3)2溶液和BaCl2溶液中,二者现
象 (填“会”或“不会”相同)
(4)若M为短周期元素形成的单质,用它制作的容器在常温下能够盛放E的浓溶液。请写出M的单质与E的浓溶液剧烈反应的化学方程式
19、下列实验操作或结论中合理的有
①用润湿的淀粉碘化钾试纸检验Cl2 ②用托盘天平直接称取0.5molNaOH固体20.00g ③在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时无须再加入蒸馏水使其液面与刻度持平 ④用酒精萃取碘水中的碘 ⑤硅酸钠溶液保存在滴瓶中 ⑥加入用HNO3酸化的Ba(NO3)2溶液检验某溶液中是否含有SO42- ⑦用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物 ⑧用25mL量筒量取2.0mL稀H2SO4 ⑨除去NO2中少量NO气体可通入纯净的O2
18、 已知A2O2-n可与B2-反应,B2-被氧化,产物为B单质,A2O2-n被还原,产物为A3+。且知100mLc(A2O2-n)=0. 3mol·L-1的溶液与150mLc(B2-)=0. 6mol·L-1的溶液恰好完全反应,则n值为( )
A.4 B.5 C.6 D.7
17、根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
K |
L |
M |
N |
P |
|
原子半径/nm |
0.136 |
0.118 |
0.089 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的水溶液酸性强弱为H2P > H2N B.L与P形成的化合物具有两性
C.单质与稀盐酸反应的速率为K<M D.K2+与N2-的核外电子数相等
16、Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li+ + FeS + 2e- == Li2S + Fe 有关该电池的下列叙述中正确的是 ( )
A.该电池的电池反应式为:2Li + FeS == Li2S + Fe
B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1 价
C.负极的电极反应式为:Al - 3e- == Al3+
D.Li-Al/FeS电池是一种一次性电池
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com