
题目列表(包括答案和解析)
4.对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显弱碱性
3. 有关化学用语正确的是
A.次氯酸的电子式:H ∶Cl∶O∶ B.二氧化硅的分子式:SiO2
C.氮气的结构式:∶N≡N∶
D.氯化镁的电子式: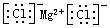
2. 下列说法中正确的是
A.SO2和SO3互为同分异构体 B.二氧化碳和干冰互为同素异形体
C.金刚石和石墨互为同位素 D.C2H5OH和CH3OCH3互为同分异构体
1. 在“十二五”期间,江苏省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.加大稀土资源的开采和出口,保证经济快速发展
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
21. (8分)将32.64 g Cu与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为NaNO3,至少需要质量分数为30%的双氧水 g。
命题、校对:徐新德
江苏省扬州中学 2010-2011学年第二学期期中考试
2010-2011学年第二学期期中考试
20. (8分)在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末收集到氢气1.12 L(标况),在此之后,又经过4 min铁粉全部溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是多少?
(2)在后4 min内用HCl表示的平均反应速率是多少?
(3)前2 min与后4 min相比,反应速率哪个较快?为什么?试解释原因。
19.(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:
他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼, 反应速率越快。 |
(1) 该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
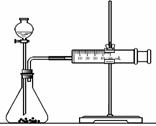 (2)乙同学为了更精确地研究浓度对反应速率的影响,利用
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用
右图装置进行定量实验。完成该实验应选用的实验药品
是 ;
应该测定的实验数据是 。
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
18. (14分)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。

|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10 mL FeSO4溶液 |
10 mL NH3 |
生成白色沉淀,后变色 |
|
2 |
10 mL H Cl |
10 mL NH3 |
|
|
3 |
30 mL NO2(主要) |
10 mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15 mL Cl2 |
40 mL NH3 |
|
请回答下列问题:
(1)实验1中,沉淀最终变为 色,写出沉淀变色的化学方程式 。
(2)实验2甲针筒内的现象是:有 生成,活塞 移动(填“向外”“向内”或“不”)。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是 ,写出NO2与H2O反应的化学方程式 。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为
, 最后针筒内剩余气体的体积约为 mL。
N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为
, 最后针筒内剩余气体的体积约为 mL。
17、(10分)元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
|
A |
|
|
||||||||||||||||
|
|
|
|
|
|
M |
B |
D |
|
|
|||||||||
|
G |
|
|
H |
|
|
Q |
R |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)Q元素在元素周期表中的位置 ,E元素原子结构示意图为_____
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是 ,其MD2分子的结构式: 。
(4) 用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
;元素G、H的金属性强弱:
16.(12分)A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2 ,DCA_________________;
(2)用电子式表示D与F形成化合物的过程 ;
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性 ;沸点的高低 ,沸点高低的原因 ;
(4)写出E与烧碱反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com