
题目列表(包括答案和解析)
24.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是 (填名称) ,W在周期表中的位置 。
(2)X与Y 形成化合物的电子式为 ,X与W组成的化合物中存在
键(填“离子”“共价”)。
(3)①写出实验室制备YX3的化学方程式:
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2 mol YX3气体时放出92.4kJ的热量,写出该反应的热化学方程式
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称
是 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
则B的化学式为 。
23. 下图中的每一个方格表示有关的一种反应物或生成物,其中X为酸式盐,A是能使澄清石灰水变浑浊的无色无味气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,请回答:
下图中的每一个方格表示有关的一种反应物或生成物,其中X为酸式盐,A是能使澄清石灰水变浑浊的无色无味气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,请回答:
(1)写出A的电子式 。干燥C所用药品是 。
(2)X形成的化合物为 化合物(填“离子”或“共价”);检验X 中阳离子的方
法是
(3)写出反应的化学方程式
C→E:____________________________
F→G:___________________________ _
(4)X与足量烧碱反应的离子方程式
22.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Mg2+、Ba2+、
Cl-、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+一定存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷
21.某混合气体中可能含有Cl2 、O2 、SO2 、NO 、NO2 中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A. 肯定有SO2 和NO B.可能有SO2 、O2和NO
C. 可能有Cl2和O2 D. Cl2和SO2至少有一种、肯有NO
20、下列离子方程式书写正确的是
A.铝粉投入氢氧化钠溶液中:2Al+2OH- 2AlO2- +H2↑
B.氯化铝溶液中加入足量的氨水:Al3++3NH3·H2O Al(OH)3 ↓+3NH4+
C.氯化铁溶液中加入铁粉:Fe3+ +Fe 2Fe2+
D.碳酸钙与盐酸反应: CO +2H+
+2H+ CO2↑+ H2O
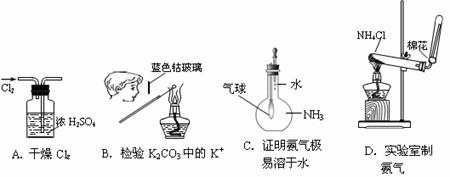
19、下图所示的实验操作,不能达到相应目的的是
18、设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A、常温常压下,48gO3含有的氧原子数为3NA
B、1.8g的NH4+ 离子中含有的电子数为0.1NA C、常温常压下,11.2 L氧气所含的原子数为NA D、2.4g金属镁变为镁离子时失去的电子数为0.1NA
17.X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
A.X的气态氢化物比Y的稳定
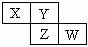 B.W的最高价氧化物对应水化物的酸性比Z的强
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
16. 4P(红磷s) P4(白磷s);△H
=+17kJ·mol-1。根据以上方程式,下列推论正确
4P(红磷s) P4(白磷s);△H
=+17kJ·mol-1。根据以上方程式,下列推论正确
的是:
A.当lmol白磷转变成红磷时放出17kJ热量 B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应 D.白磷热稳定性比红磷小
15.在一条件下,反应N2+3H2
 2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol/(L·min) B.1.0 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com