
题目列表(包括答案和解析)
5.常用的几种灭火器(如图1-22所示)

Ⅰ泡沫灭火器
(1)使用方法;头朝下倒转过来,使筒内的两种药液混合;
(2)灭火原理;CO2和泡沫使燃烧物与空气隔绝;
(3)可用灭火种类:木材、棉布等.
Ⅱ干粉灭火器
(1)使用方法:用压缩的CO2吹干粉(NaHCO3);
(2)可用灭火种类:一般火灾及油、气等类的火灾.
Ⅲ液态二氧化碳灭火器
(1)使用方法:手先握在钢筒的木柄上,然后打开螺帽;
(2)可用灭火种类:图书档案、贵重设备、精密仪器等类的火灾.
4.常见易燃物和易爆物的安全认识
Ⅰ易燃物和易爆物
一般来说,易燃物指的是那些易燃的气体和液体,容易燃烧、自燃或遇水可以燃烧的固体,以及一些可以引起其他物质燃烧的物质等.易爆物指的是那些受热或受到撞击时容易发生爆炸的物质.
Ⅱ几种消防安全标志(如图1-21所示)
3.自燃
自燃也是一种燃烧,它是由缓慢氧化而引起的自发燃烧现象.如稻草、麦秆、煤屑、沾有油的布等大量堆积在不通风的地方,常因缓慢氧化产生的热不易散发,积累起来使堆积物的温度逐渐升高,以致达到可燃物的着火点,引起自发燃烧.
[注意]①自燃一般是由缓慢氧化而引起的,但缓慢氧化不一定引起自燃.
②燃烧、缓慢氧化、自然的相同点:均是氧化反应,都放热.
例如:燃烧、缓慢氧化和自燃的相同点是 ( )
A.反应都需点燃 B.反应都有火焰
C.反应都很剧烈 D.都属于氧化反应
(分析) 燃烧反应不一定都需点燃,如在空气中加热红磷达245℃,它就能燃烧(其中“加热”和“点燃”是不同的实验操作),缓慢氧化和自燃不需点燃,故不选A;燃烧和自燃不一定有火焰,缓慢氧化一定无火焰,故B是错误的;缓慢氧化反应不剧烈,因此C也是错误的.
答案:D
又如:下列过程中,属于燃烧的是_____;属于缓慢氧化的是________;属于物理变化的是_______.
A.通电发光、发热 B.铁钉生锈
C.白磷自燃 D.用粮食酿酒
E.呼吸作用 F.自行车轮胎爆炸
G.把红热的细铁丝伸入氧气瓶中 H.把盛有木炭的燃烧匙伸入氧气瓶中
(分析) 上述几种概念的联系和区别:
由于燃烧需同时满足两个条件:一是可燃物与氧气接触;二是可燃物的温度要达到着火点.同时,燃烧是剧烈的发光、发热的氧化反应.
具有上述特点的是C、G;B、D、E是比较典型的缓慢氧化;A、F在变化中无新物质生成,属于物理变化;H由于木炭未经点燃,即没有达到木炭的着火点,不会燃烧, 既无物理变化,也无化学变化.
答案:CG;BDE;AF
再如:在空气中同时加热白磷和红磷,结果发现白磷燃烧了一会儿后,红磷才燃烧,这是因为_______.用扇子扇燃着的蜡烛,一扇就灭,其原因是_______;已发红的煤炉火用扇子越扇越旺,其原因是______.
(分析) 解答此题,应抓住两点:(1)使可燃物着火,需同时满足两个条件;(2)使燃着的物质熄灭,只需隔断一个条件即可.同时理解物质燃烧的剧烈程度与氧气的浓度和与氧气的接触面积的关系.
答案:红磷的着火点高于白磷的着火点;扇子扇使空气流通,空气带走了蜡烛燃烧放出的热,使其温度降低到着火点以下;扇子扇不能使高温下的煤炉温度下降,反而增加了氧气的流通量
2.缓慢氧化
Ⅰ定义:物质在空气中进行的非常缓慢的、不易被人察觉的氧化反应.
Ⅱ伴随现象:发热、不发光.如金属生锈、酿酒、食物腐败、动植物的呼吸等.
1.燃烧
Ⅰ定义
(1)狭义:可燃物与空气里的氧气发生的一种发光、发热的剧烈氧化反应叫燃烧.
(2)广义:任何发光、发热的化学反应都叫做燃烧(以后学到).
Ⅱ条件
(1)可燃物与空气(或氧气)接触.
(2)温度要达到着火点.
[注意] ①着火点是一个定值.
②要使燃烧停止(即熄灭),只要使燃烧物和空气隔绝,或使燃烧物的温度降低到它的着火点以下即可。
Ⅲ分类
燃烧还分为完全燃烧和不完全燃烧两种.燃料不完全燃烧产生的气体极具可燃性,降低了热能的利用率,很多还会造成对大气的污染.因此要设法使燃料完全燃烧. 一般采取将固体燃料粉碎、将液体燃料喷成雾状的方法来增加燃料和空气的接触面积,使之完全燃烧.另外,采用通风等措施,也可以提高燃料的利用率.
25.位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是地壳中含量最高的金属。
根据你的推断完成下列问题:
(1)B元素的名称为________周期表的位置_______E的元素符号为_________。
(2)由A、B两种元素形成的原子个数比为1∶1的化合物的电子式__________。
(3)写出由上述元素形成的具有漂白作用的两种物质的化学式_____________、
____________________。
(4)用电子式表示C与D形成化合物的过程____________________________。
(5)写出E的最高价氧化物与强碱反应的离子方程式_____________________。
附加题:★★26.(16分)
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
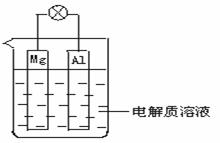
(1) (8分)电解质溶液为稀H2SO4时,灯泡____(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
b.若灯泡不亮,其理由为:_________________________________.
(2) (8分)电解质溶液为NaOH(aq)时,灯泡____(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
b.若灯泡不亮,其理由为:________________________.
24.在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有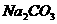 溶液的棉花。给试管加热,观察现象。当反应一段时间以后,停止加热。回答下列问题:
溶液的棉花。给试管加热,观察现象。当反应一段时间以后,停止加热。回答下列问题:
 (1)写出a处反应的化学方程式
,
(1)写出a处反应的化学方程式
,
浓硫酸所体现的作用是 性。
(2)试管中的液体反应一段时间后, 处滤纸条的变化为
。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
处滤纸条的变化为
。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)待试管中液体冷却后,取试管上层液体加入一支试管中,再慢慢加入少量水,可观察溶液呈 色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是
(5)如果浓硫酸的浓度为 ,铜片是过量的,加热使之反应,当被还原的硫酸为
,铜片是过量的,加热使之反应,当被还原的硫酸为 。则浓硫酸的实际体积
(填写“大于”、“等于”或“小于”)
。则浓硫酸的实际体积
(填写“大于”、“等于”或“小于”) 。
。
23.下列物质①N2、②H2O、③Na2O2、④CaCl2、⑤KOH、⑥NaF、⑦ NH4Cl 中,只含有共价键的物质是_________________,只含有离子键的物质是___________,既含有离子键,又含有共价键的物质是____________,离子化合物是__________,共价化合物是_________(请用序号填空)
20.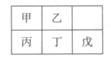 短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是( )
A.原子半径: 丙<丁<戊 B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
★21.铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
★22.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.1mol B.0.05mol C.1.05mol D.0.11mol
第Ⅱ卷 非选择题 (共76分)
19.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是( )
A.Q1>Q2>Q3 B. Q1+ Q2>2Q3 C. Q1+Q2<Q3 D. Q1+ Q2<2Q3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com