
题目列表(包括答案和解析)
⒒ 设NA为阿伏加德罗常数,下列说法不正确的是
A. 16 gCH4分子中共价键总数为4NA
B. 常温常压下,11.2 L H2O中含有5NA个电子
|
D. 1 molCu与足量的浓硝酸反应产生2NA个NO2分子
⒓ 类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是
A. 钠在空气中燃烧生成的氧化物是Na2O2,则锂在空气中燃烧生成的氧化物也是Li2O2
B. CO2和SiO2的化学式相似,则CO2和SiO2的物理性质也相似
C. Fe与Cl2反应生成FeCl3,则Fe与Br2反应可生成FeBr3
D. 将SO2通入品红溶液中,溶液褪色后加热恢复原色,则将SO2通入溴水,溴水褪色后加热也能恢复原色
⒔ 下列说法中,正确的一组是
① 1H、2H、3H是氢元素的三种核素
② MgSO4晶体中既存在离子键,又存在共价键
③ 常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键
④ 浓硫酸有强氧化性,常温下能与Cu发生剧烈反应
⑤ 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
⑥ NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3∶1
A. ①②③ B. ①②⑤ C. ②③④ D. ④⑤⑥
⒕ 下列说法正确的是
A. Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
B. 原子序数为15的元素的最高正化合价为+3
C. 非金属元素组成的化合物一定是共价化合物
D. 在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
⒖ X、Y为短周期元素,X位于ⅠA,X与Y可形成化合物X2Y,下列说法不正确的是
A. X的原子半径不一定大于Y的原子半径
B. X与Y的简单离子可能具有相同的电子层结构
C. X、Y两种元素形成的化合物中,原子个数比不可能为1∶1
D. X2Y可能是离子化合物,也可能是共价化合物
⒗ 下列关于离子检验的说法中,正确的是
A. 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32-
B. 向某溶液中加入AgNO3溶液,生成白色沉淀,则该溶液中一定含有Cl-
C. 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则该溶液中一定含有SO42-
D. 向某溶液中加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则该溶液中一定含有NH4+
|
|
|
|
|
|
|
|
|
|
|
|
|
⒉ 不会造成空气污染的气体是
A. N2 B. NH3 C. NO2 D. SO2
⒊ 下列说法正确的是
A. Na和Rb属于第ⅠA族元素,Rb失电子能力比Na强
B. C和Si属于第ⅣA族元素,SiH4比CH4稳定
C. P和S属于第三周期元素,P原子半径比S小
D. Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4弱
⒋ 下列原子序数所对应的元素组中,两者可形成离子键的是
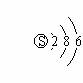 A. 1和17
B. 12和9
C. 14和6
D. 15和8
A. 1和17
B. 12和9
C. 14和6
D. 15和8

 ⒌ 下述各项表达中正确的是
⒌ 下述各项表达中正确的是
A. Na2O2的电子式为Na︰O︰︰O︰Na B. 16S的结构示意图为
C. 16O和18O核外电子排布方式不同 D. 在氮原子中,质子数为7而中子数不一定为7
⒍ 某溶液中存在较多的OH-、K+、CO32-,该溶液中还可能大量存在的是
A. H+ B. Ca2+ C. NH4+ D. SO42-
⒎ 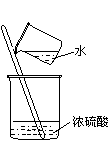

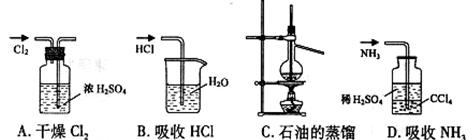 用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是

⒏ 化学与工农业生产和人类生活密切相关。下列说法中正确的是
A. 采用原煤脱硫技术,可减少燃煤产生的SO2
B. “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
C. 自来水厂可用氯气来杀菌消毒,因此氯气无毒
D. 高纯度的硅单质广泛用于制作光导纤维
⒐ 下列物质属于离子化合物的是
A. 氯化氢 B. 苛性钠 C. 硫酸 D. 二氧化碳
⒑ 对于ⅦA族元素,下列说法不正确的是
A. 可形成-1价离子 B. 从上到下原子半径逐渐增大
C. 从上到下沸点逐渐降低 D. 从上到下非金属性逐渐减弱
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5
32.将10 g铁置于40 mL某浓度的硝酸中,再微热充分反应后,共收集到1792 mL混合气体,溶液里还残留4.4 g固体(标准状况)。求:
(1)反应被还原的硝酸与未被还原的硝酸的物质的量
(2)原硝酸溶液的物质的量浓度
(3)混合气体的组成成分及其体积比
2010学年第二学期浙东北(ZDB)三校联考
31.氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
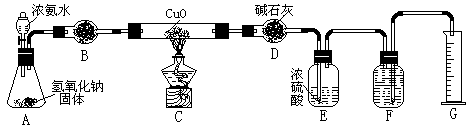
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢氧化钠
(4)E装置中盛装浓硫酸的目的是: ;
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.

②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
30.(10分)氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+、N2H6+等。已知N2H5+的形成过程类似于NH4+的形成过程,N2H5+在碱性溶液中将生成电中性的分子和水。试写出:
(1)该电中性分子的化学式: ;
(2)N2H5+的电子式: ;
(3)1 mol N3-共有 mol 电子;
(4)写出两种非金属氧化物跟N3-电子数相同的物质的化学式 、 。
29.(6分)某化学反应2A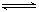 B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
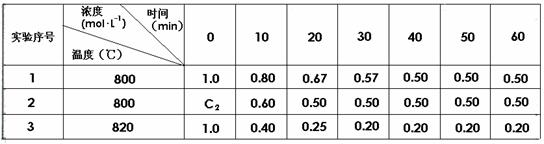
根据表中数据,完成下列填空:
(1)在实验1中,A在10-20 min内的平均速率为 ;
(2)在实验2中,A的初始浓度c2为 mol·L-1,反应经20 min就达到平衡,可推测实验2中隐含的条件是 。
28.(8分)第三周期元素A、B、C,其原子序数逐渐增大,已知三种原子最外层共有10个电子,这三种元素的最高价氧化物的水化物有一种具有两性,且它们最高价氧化物的水化物两两之间都能反应生成盐和水,则:
(1)指出C元素在周期表中的位置
(2)写出B原子的结构示意图
(3)A和C形成的化合物的电子式为 ,属于 晶体
(4)写出单质B和A的最高价氧化物的水化物反应的离子方程式 。
27.(4分)(1)0.3 mol气态高能燃料乙硼烷(分子式为B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,写出上述燃烧反应的热化学方程式:
;
(2)配平下列反应方程式:
□Na2SO3+□KIO3+□H2SO4=□Na2SO4+□K2SO4+□I2+□H2O
26.化学反应可视为旧化学键断裂和新化学键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是a kJ·mol-1,H-H键的键能是b kJ·mol-1;由N2和H2合成1 mol NH3时可放出c kJ的热量。那么N-H 键的键能是
A.(a+3b-2c)/2 kJ·mol-1 B.(a+3b+2c)/6 kJ·mol-1
C.(a+3b-2c)/6 kJ·mol-1 D.(a+3b+2c)/3 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com