
题目列表(包括答案和解析)
6.关于硅的叙法不正确的是 ( )
A.高纯硅是良好的半导体
B.硅是制造太阳能电池的常用材料
C.硅的化学性质不活泼,常温下不与任何物质反应
D.硅在地壳中含量居第二位,但在自然界中没有游离态的硅存在
5.下列说法错误的是 ( )
A.原子半径:F<Mg<K B.稳定性:PH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4 D.碱性:Al(OH)3<Mg(OH)2<KOH
4.下列有关碱金属的说法中,正确的是 ( )
A.金属锂应保存在煤油中
B.金属钾着火应用泡沫灭火剂更好
C.它们都能在空气里燃烧生成M2O(M表示碱金属)
D.碱金属单质随着核电荷数的递增与水反应的剧烈程度逐渐加剧直至燃烧爆炸
3.下列关于浓硝酸和浓硫酸的叙述错误的是 ( )
A.都是常用的干燥剂
B.分别露置在空气中,容器内溶质的物质的量浓度都降低
C.都可以储存于铝制槽罐中
D.和铜反应中都表现出强氧化性和强酸性
2. 下列关于氯水的叙述正确的是 ( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出该气体是Cl2
D.氯水放置数天后PH变大
1.下表是某城市空气质量日报公布的部分内容。对表中3个空气质量指标不会产生影响的是 ( )
|
项目 |
空气污染指数(API) |
空气质量级别 |
空气质量描述 |
|
可吸入颗粒物 |
52 |
Ⅱ |
良 |
|
二氧化硫 |
7 |
I |
优 |
|
二氧化氮 |
24 |
I |
优 |
A.焚烧垃圾 B.使用含磷洗衣粉
C.汽车排放的尾气 D.用煤和石油产品作燃料
23.(15分)某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
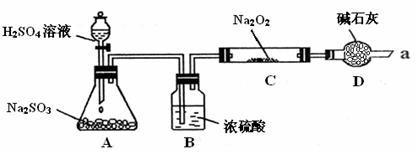
Ⅰ. 装置A中盛放浓硫酸的仪器名称是 ,其中发生反应的化学方程式为 。
Ⅱ. 如何检验反应中是否有O2生成 。
Ⅲ. 装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以
。
Ⅳ. 对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
⑴ 假设1的反应方程式:2SO2+ 2Na2O2= 。
⑵ 若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选实验试剂帮助他完成该探究过程,并将答案写在相应位置。
限选实验试剂:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1 mol/L HNO3溶液、4 mol/L盐酸。
|
实验操作 |
预期现象 |
结 论 |
|
步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,然后将所得溶液分置于A、B试管中 |
固体完全溶解,得到无色透明溶液 |
|
|
步骤二:向A试管中滴加 ,振荡,观察溶液颜色变化。 |
|
假设1 或假设3成立;若没有该现象则假设2成立。 |
|
步骤三:向B试管中先滴加
, 再滴加 。 |
产生
, 再加入试剂看到产生白色沉淀。 |
假设3成立;若无白色沉淀产生则假设1成立。 |
22.(17分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
⑴ W、X各自的最高价氧化物对应的水化物可以反应生盐和水, W、X的活泼性顺序为 >
(填元素符号),判断的实验依据是 (写出一种)。
⑵ W与Y 可形成化合物W2Y,元素Y的离子结构示意图为 。Y的最高价氧化物对应水化物的浓溶液与Cu反应的化学方程式是 。
⑶ 硒(Se)是人体必需的微量元素,与Y同一主族,Se原子比Y原子多一个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。
⑷ Z位于元素周期表第 周期第 族。能说明Z的非金属性比Y的非金属性强的事实是 (举一例)。
⑸ 元素Y的氢化物的还原性比元素Z的氢化物的还原性 (填强或弱)。
⑹ W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 > > > (用
离子符号表示)。
21.(14分)A、B、C、D、E、F和G是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
① A、B、E、F能使湿润的蓝色石蕊试纸变红,G能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色;
② A和G相遇产生白烟;
③ B和E都能使品红溶液褪色;
④ 将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤ C和D相遇生成红棕色气体;
⑥ F在D中燃烧可以产生E和H2O。
回答下列问题:
⑴ A的分子式是 ;②中白烟的化学式是 ,其中的化学键类型为 。
⑵ ④中发生反应的化学方程式是 。
⑶ ⑤中发生反应的化学方程式是 。
⑷ ⑥中发生反应的化学方程式是 。
⑸ 在光照条件下,B(B的组成元素W)和氢气反应过程如下:
① B = W + W ② W + H2= HW + H ③ H + B = HW + W ……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属于 键(填“极性”或“非极性”)。
⒘ 下列反应的离子方程式正确的是
A. AlCl3溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
B. 过量二氧化硫通入氢氧化钠溶液中:SO2 + OH- = HSO3-
C. 单质铜与稀硝酸反应:Cu + 2H+ + 2NO3- = Cu2+ + 2NO↑+ H2O
D. 氯化钡溶液与硫酸反应:Ba2+ + SO42- = BaSO4↓
⒙ 下列实验能达到预期实验目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将在空气中放置已久的镁、铝两种元素的块状单质分别和热水作用,并滴入酚酞溶液 |
比较镁与铝的金属性强弱 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯气与溴的氧化性强弱 |
|
C |
将CO2通入到Na2SiO3溶液中产生白色浑浊 |
比较C和Si的非金属性强弱 |
|
D |
将亚硫酸钠试样溶于适量的水中,再加入过量用稀硝酸酸化的氯化钡溶液 |
检验亚硫酸钠试样是否变质 |
⒚ 根据相关化学原理,下列判断一定正确的是
A. 含有共价键的化合物可能是离子化合物
B. A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
C. 若R2-和M+的电子层结构相同,则R原子的核电荷数比M原子的小
D. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
⒛ X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
|
X |
Y |
|
|
|
Z |
W |
A. 原子半径:W > Z > Y > X
B. 最高价氧化物对应水化物的酸性:Z > W > X
C. Y的氢化物比Z的氢化物稳定
D. W单质能与水反应,生成一种具有漂白性的物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com