
题目列表(包括答案和解析)
28、(12分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
(1)铜与稀硝酸反应的离子方程式 。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体__ _(填“能”或“不能”),
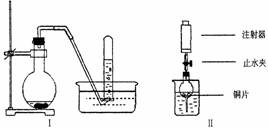 简述理由
简述理由
。
(3)若用Ⅱ实验装置进行实验,以证明铜与
稀硝酸反应生成的气体是NO,在烧杯中加入
一定体积的稀硝酸,打开止水夹,用注射器慢
慢抽取干燥管内的空气,稀硝酸沿着干燥管慢
慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象__________________ ____。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象 。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是 。
27、(6分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3-、Cl-、I-,取该溶液进行如下实验:k*s*5u
(1)用pH试纸检验,其pH=1;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中发现,先生成白色沉淀,后沉淀全部溶解;
(4)取部分上述呈碱性的溶液,加Na2SO4溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
请根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,还不能确定是否存在的上述离子有 。
26、(8分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大,五种元素中只有一种为金属元素。B元素原子L层上的电子数为K层电子数的2倍;元素D2-的核外电子排布与氖原子相同;E与A同主族;A和E 这两种元素与D都能形成X2Y、X2Y2型化合物。请回答下列问题:
(1)画出D的原子结构示意图______________。
(2)B在周期表的位置为 ;
(3)A的X2Y型化合物的电子式是_______ ________。
(4)A、D、E形成化合物电子式为 。
(5)B、D形成最高价化合物的结构式 ,其固体属于 晶体。
25、(8分)0.5mol 的Y元素的离子得到6.02×1023个电子被还原成中性原子,0.4gY的氧化物恰好与100ml 0.2mol·L-1 的盐酸完全反应,Y原子核内质子数和中子数相等。请写出:
(1)Y的名称为 ,它在周期表的位置为 ;
(2)Y的氧化物与盐酸反应的离子方程式为 。
(3)Y与二氧化碳反应的化学方程式为 。
23、(4分)请配平下化学方程式,并标出电子转移的方向与数目:
FeSO4 + KNO3 + H2SO4- K2SO4 + Fe2(SO4)3 + NO↑+ H2O
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
|
2 |
Li |
Be |
B |
① |
② |
O |
③ |
||
|
3 |
④ |
⑤ |
⑥ |
⑦ |
P |
⑧ |
⑨ |
(1)最高价氧化物的水化物酸性最强的酸是 。
(2)①的气态氢化物分子的结构式为 ;②的气态氢化物的电子式为 。
(3)③的气态氢化物稳定性比⑧的气态氢化物______。(填“强”、“弱”或“相同”)
(4)由Li与⑨形成的化合物的电子式为______________________。
(5)④、⑤、⑥原子半径由大到小的顺序是 。
(6)⑦的原子结构示意图为________________________。
(7)⑥的最高价氧化物与NaOH溶液反应的离子方程式为 ,
22、某金属的硝酸盐加热分解生成的NO2和O2的物质的量之比8∶1。在加热过程中,该金属元素的化合价:
A、降低 B、升高 C、不变 D、无法确定
卷Ⅱ(共56分)
21、密度为0.91 g·cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,溶液中溶质的质量分数为:
A、等于12.5% B、大于12.5% C、小于12.5% D、无法确定
20、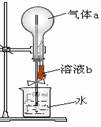 如右图所示,在干燥的圆底烧瓶中充满某气体a,胶头滴管中吸有少量液体b,当把溶液b挤进烧瓶后,打开止水夹不能形成“喷泉”的组合是:
如右图所示,在干燥的圆底烧瓶中充满某气体a,胶头滴管中吸有少量液体b,当把溶液b挤进烧瓶后,打开止水夹不能形成“喷泉”的组合是:
|
|
干燥气体a |
液体b |
|
A |
NH3 |
水 |
|
B |
HCl |
水 |
|
C |
CO2 |
NaOH溶液 |
|
D |
Cl2 |
饱和食盐水 |
19、下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是:
A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
18、下列叙述正确的是:
A、同一主族的元素,原子半径越大,其单质的熔点一定越高
B、同一周期元素的原子,半径越小越容易失去电子
C、同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D、稀有气体元素的原子序数越大,其单质的沸点一定越高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com