
题目列表(包括答案和解析)
30、已知反应:N2+3H2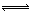 2NH3 在一个容积为5L 的密闭容器中,装入2 molN2和8molH2,,在一定条件下反应5分钟后,测得NH3的浓度为0.5mol/L,求v(N2)、v(H2)、v(NH3)。
2NH3 在一个容积为5L 的密闭容器中,装入2 molN2和8molH2,,在一定条件下反应5分钟后,测得NH3的浓度为0.5mol/L,求v(N2)、v(H2)、v(NH3)。
29.某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置,甲中锥形瓶内盛放的是100ml稀盐酸(反应前后溶液体积变化可以忽略不计)。
(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较___________ ;
(2)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件。实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证_______________________ ;
(3)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1-t2时间内速率逐渐加快说明该反应是 (填放热或吸热)反应,t2-t3时间内速率逐渐减慢的主要原因是___ ___ ;

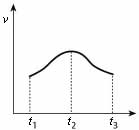
图1 图2
(4)如果在相同条件下,把甲锥形瓶内盛放稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,原因可能是 ;
28.现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。已知:
①常温下,F的单质是一种黄绿色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物G分子中含有10个电子,且可以发生下列转化:
 G
P
Q
M+P ,其中P为无色气体,Q为红棕色气体;
G
P
Q
M+P ,其中P为无色气体,Q为红棕色气体;
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 ;
(3)请指出C元素元素周期表中位置: ;
(4)G的电子式为 ;
(5)化合物X所含化学键类型有 ;
(6)①A的氧化物与NaOH溶液反应的离子方程式为 ;
②M的稀溶液与铜反应的化学方程式为 。
27.(10分)对于反应2S02(g)+02(g)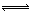 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
|
编号 |
改变的条件 |
生成SO3的速率 |
|
① |
升高温度 |
|
|
② |
降低温度 |
|
|
③ |
增大氧气的浓度 |
|
|
④ |
使用催化剂 |
|
|
⑤ |
压缩体积 |
|
26. (10分)有几种元素的微粒电子层结构如右图所示,其中:
(1)某电中性微粒一般不和其他元素的原子反应,这种微粒符号是______ ;
(2)盐溶液中的某微粒与AgNO3溶液反应时会出现白色浑浊,这种微粒符号是____ ,生成该白色浑浊的离子方程式为 ;
(3)某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是_______,该微粒的电子式为:
25. 一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
A.单位时间内生成n molA2同时生成n molAB
B.单位时间内生成2n molAB的同时生成n molB2
C.容器内气体总压强不再随时间的变化而变化
D.容器内混合气体的平均摩尔质量不再随时间的变化而变化
 第II卷(非选择题,共50分)
第II卷(非选择题,共50分)
24.在2 L密闭容器中,发生3A(g)+B(g)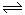 2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·S-1,则10 s后容器中B的物质的量浓度是
2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·S-1,则10 s后容器中B的物质的量浓度是
A.1.4 mol·L-1 B.1.6 mol·L-1 C.1.8 mol·L-1 D.3.2 mol·L-1
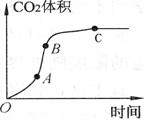
23.某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积
的变化),实验结果如图所示,下列说法错误的是
A.AB段反应速率最快的原因可能是反应放热,体系温度升高
B.BC段反应速率变慢的原因可能是盐酸浓度降低
C.该反应速率也可以用CaCl2的浓度变化与时间关系来表示
D.C点后CO2体积不变的原因一定是盐酸消耗完
22、把下列4种X溶液分别加入4个盛有10mL2 mol/L盐酸的烧杯中,均加入水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是
A.10℃20mL3 mol/L的X溶液 B. 20℃30mL2 mol/L的X溶液
 C.20℃10mL4 mol/L的X溶液 D. 10℃20mL2 mol/L的X溶液
C.20℃10mL4 mol/L的X溶液 D. 10℃20mL2 mol/L的X溶液
21.X、Y、Z、M、N代表五种金属,它们之间有以下反应:①水溶液中:X + Y2+ = X2++ Y
② Z + 2H2O(冷水)= Z(OH)2+ H2↑ ③ M、N为电极,与N盐组成原电池,电极反应为:M -2e- = M2+
④ Y可以溶于稀硫酸,M不被稀硫酸氧化,则这五种金属活泼性由强到弱的顺序是
A.Z>X>Y>N>M B.Z>Y>X>M>N C.Z>X>Y>M>N D.Y>M>N>Z>X
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com