
题目列表(包括答案和解析)
3、下列反应属于氧化还原反应,又属于离子反应和化合反应的是 ( )
A、硅和氢氧化钠溶液反应 B、二氧化碳通入饱和Na2CO3溶液
C、氢气在氯气中燃烧 D、氯气通入到氯化亚铁溶液中
2、用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是 ( )
A、称量时,将固体NaOH直接放在天平右盘上
B、将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C、定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D、将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
1、硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是 ( )
A. B. C. D.




|
|
|
|||||||
|
|||||||||
27.(8分)现有某混合物的水溶液,含有以下离子中的若干种:Na+、NH4+、Cl-、Ba2+、HCO3-、SO42-,取该溶液分别进行如下实验:
①取100mL,加足量NaOH溶液,加热,收集到标准状况下的气体448mL
②另取100mL,加足量Ba(OH)2溶液,得到沉淀4.30克,再用足量盐酸洗涤,干燥后,沉淀质量为2.33克
(1)溶液中一定含有 ▲ 离子,可能含有 ▲ 。
(2)计算原溶液中一定存在的各阴离子的物质的量浓度
26.(4分)将2.56 g 铜粉与10mL浓硝酸反应,充分反应后收集到NO2和NO气体积为1.12L(标准状况下),测得溶液中剩余H+的物质的量浓度为1.0mol/L,试计算原浓硝酸的物质的量浓度(溶液体积变化忽略不计)。
(1)补充完成下列实验步骤:
①检查装置的气密性。
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到
_ ▲ 为止。
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有 ▲ 色气体产生,溶液呈蓝色,随着反应不断进行,最后反应自行停止。该过程反应的离子方程式为 ▲ 。
(3)为了进一步证明反应确实生成的NO,还需要的操作及看到的现象为 ▲ 。
 (4)以下收集NO气体的各种装置中,合理的是 ▲ (填选项代号)。
(4)以下收集NO气体的各种装置中,合理的是 ▲ (填选项代号)。

25.(10分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
Ⅰ 定性研究亚硫酸钠被氧化的程度
假设1:亚硫酸钠未被氧化;假设2:亚硫酸钠完全被氧化
假设3: ▲ ;
请设计实验方案证明假设3成立的操作步骤及实验现象 ▲
Ⅱ 定量研究亚硫酸钠被氧化的程度
根据某同学设计的如下图装置回答下面的问题:
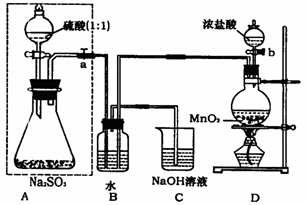
(1)B装置中反应的离子方程式为 ▲ 。
 (2)称量ag Na2SO3样品放入锥形瓶中,待A、B装置中都反应完全后,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分数为 ▲ 。某同学认为上述实验设计中存在一明显不足,不足之处为 ▲ 。
(2)称量ag Na2SO3样品放入锥形瓶中,待A、B装置中都反应完全后,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分数为 ▲ 。某同学认为上述实验设计中存在一明显不足,不足之处为 ▲ 。
24. (9分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(9分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
23.(8分)某类化学反应可用如下通式表示:A + B → C + D + H2O 请按要求回答问题:
(1)若A、C、D中均含有氯元素,且A中的Cl的化合价介于C和D之间,写出
该反应的离子方程式: ▲
(2)若A是紫红色金属,D为红棕色气体,写出该反应的化学方程式:
▲
(3)若C和D均为气体且都能使澄清的石灰水变浑浊,A呈固态,则B的化学
式为 ▲ ;若产物D是还原产物,其化学式为 ▲ 。
(4)若C是常见的碱性气体,D是一种固体可作干燥剂(中性),则化学式依次为:
A(盐) ▲ B ▲ 。
22.(13分)现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:

④E和D是同主族元素,氢化物(H2E)常温下为气态。
⑤B和D可形成微粒个数比为1∶1和2∶1的离子化合物X和Y。
请回答下列问题:
(1)C元素在周期表的位置 ▲ ;B2E的电子式为 ▲ 。
(2)A元素的原子结构示意图是 ▲ 。化合物X所含化学键类型有 ▲ 。
(3)G气体的检验方法为 ▲ 。
(4)E的非金属性比F ▲ (填“强”或“弱”),并用化学事实加以说明(用化学方程式表示) ▲ 。
21.(8分)含放射性的131I的碘(131I)化钠口服溶液在临床医学上常用于治疗甲亢。某碘(131I)化钠口服溶的说明书摘录(部分)如右图,按要求回答下列问题。
(1)稳定剂Na2SO3可起到防止I-被氧化的作用,由此可推测还原性:SO32- ▲ I-(填“>”、“<”或“=”)
(2)某反应体系中存在下列物质:I2、NaI、Na2SO4、Na2SO3、NaOH、H2O。
上述反应体系中化学反应方程式为__________▲______________
(3)在水溶液中,YO3n-和SO32-发生反应的离子方程式如下:
YO3n-+3SO32-=Y-+3SO42-
①YO3n-中n= ▲ ;②Y元素原子的最外层电子数是 ▲ ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com