
题目列表(包括答案和解析)
23、(10分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65)。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 。
A、200 mL B、400 mL C、500mL
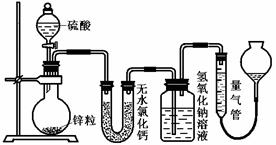
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到Vml气体,则有:ag/65g·mol-1=bg/64g·mol-1+V ml/ 22400 ml·mol-1,依据的原理是 。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)= (用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将 (填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意(至少写出两条):
①
②
22、(7分)下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:
|
使用说明书 |
|
|
主要成分 |
活性分子碘含量:1.5mg/片 |
|
贮藏 |
遮光、密闭、在阴凉处保存 |
|
有效期 |
二年 |
请根据上述说明回答:
(1)推断华素片________(填“是”或“不是”)白色。
(2)某同学欲证实该药片中确定含有分子碘,设计并完成如下实验:
①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两支试管中备用。
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,上层液体颜色为________色,所加试剂为下列中的________,由此说明分子碘的存在。
A.苯 B.酒精 C.四氯化碳 D.盐酸
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
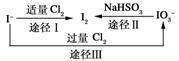
①如以海水为原料制取I2,加入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该反应产物中,IO与Cl-的物质的量之比为1∶6,则氧化剂和还原剂的物质的量之比为 。
②如以途径Ⅱ在溶液中制取I2,反应 后的溶液显酸性,则反应离子方程式是
后的溶液显酸性,则反应离子方程式是
。
21、(6分)在一瓶无色澄清的溶液中,可能含有Cl-、Cu2+、SO42-、CO32-、Na+、Mg2+、Ba2+这七种离子中的某几种,对此进行实验:① 向少量该溶液中加入NaOH溶液,产生白色沉淀;② 取少量原溶液,加入BaCl2溶液产生白色沉淀。
(1)该溶液中一定含有的离子是 ;一定不含有的离子是 。
(2)为检验可能存在的阴离子,需要进行的实验是 。
20、(6分)(1)实验室制取氢氧化铁胶体的方法是 ,可用 (方法)证明胶体已经制成。
(2)现有以下物质:①NaCl晶体 ②干冰 ③稀醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的KNO3 ⑨氨水 ⑩冰醋酸(纯净的醋酸CH3COOH)
请回答下列问题(用序号):
以上物质中能导电的是 ;以上物质中属于电解质的是 。
19、(4分)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠俗称 ,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者(填>、<或=)。
(2)碳酸氢钠可治疗胃酸(0.2%-0.4%的盐酸)过多,反应的离子方程式为:
。
18、在硫酸铁溶液中加入ag铜,完全溶解后,再加入b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是 ( )
A、残余固体全部是铜 B、残余固体可能为铁和铜的混合物
C、残余固体是铁,溶液中一定不含Cu2+ D、最后得到的溶液中可能含Fe3+
17、以下非金属氧化物与其引起的环境问题及主要来源对应正确的是 ( )
|
|
氧化物 |
环境问题 |
主要来源 |
|
A |
CO2 |
酸雨 |
化石燃料的燃烧 |
|
B |
SO2 |
光化学烟雾 |
汽车尾气的排放 |
|
C |
NO2 |
温室效应 |
工厂废气的排放 |
|
D |
CO |
CO中毒 |
汽车尾气和化石燃料的不完全燃烧 |
16、某一反应体系有反应物和生成物的粒子共六种:SO32-、I2、H+、SO42-、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,下列判断不正确的是 ( )
A、该反应体系所发生的氧化还原反应中,SO32-为还原产物
B、该反应的离子方程式为:SO32-+I2+H2O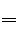
 SO42-+2I-+2H+
SO42-+2I-+2H+
C、利用该体系内所发生反应的原理可用于测定Na2SO3变质情况
D、根据该体系的反应可推知氧化性:I2>H2SO4(稀)
15、在强酸性溶液中能大量共存,且溶液为无色透明的离子组 ( )
A、K+、Na+、AlO2-、NO3- B、NH4+、Al3+、NO3-、SO42-
C、K+、NH4+、SO32-、S2- D、K+、Ag+、NO3-、Br-
14、某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不滴落,而是好像有一层膜兜着。对该现象的说法错误的是 ( )
A、兜着液体的这层膜是氧化铝
B、该实验说明了氧化铝的熔点高于铝的熔点
C、铝极易与空气中的氧气反应在表面形成氧化物保护膜
D、铝的化学性质较稳定,即使加热到熔化也不与空气中的氧气反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com