
题目列表(包括答案和解析)
21.用碳棒作电极电解下列物质的水溶液,一段时间后,加入适量括号内物质,可使溶液恢复原溶质原浓度的是
A.NaCl (NaCl ) B.MgSO4 (MgO) C.CuSO4 (CuCO3) D.CuCl2(CuCl2)
20.已知: 2H2 (g)+O2 (g)=2H2O(l) △H= a kJ/mol,
2H2 (g)+O2 (g)=2H2O(g) △H= b kJ/mol, 则a、b的大小关系是
A.a=b B. a>b C.a<b D.无法确定
19. 原子序数大于4的主族元素X、Y的离子Xm+、Yn-电子层结构相同,则X、Y的下列叙述正确的是
①原子序数X>Y ②X和Y在同一周期 ③Y与X族序数之差是8-(m+n) ④X、Y核电荷数差为(m-n)
A.①③ B.②④ C.①② D.①②③
18. 下列各项中表达正确的是
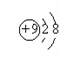
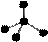
 A. N2的电子式: B.二氧化碳分子的结构式为 O-C-O
A. N2的电子式: B.二氧化碳分子的结构式为 O-C-O
C.CH4分子的比例模型: D.F - 的结构示意图
17. 下列实验中,反应速率加快是由催化剂引起的是
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
D.双氧水中加入少量MnO2,即可迅速放出气体
16. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd +
2NiOOH + 2H2O Cd(OH)2
+2Ni(OH)2
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd +
2NiOOH + 2H2O Cd(OH)2
+2Ni(OH)2
有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH- 向正极移动
15.X元素原子的质量数为m,核内中子数为n,则w g X2+ 离子含有的电子的物质的量约为
A.(m+n+2)w/m mol B. (m-n+2)w/m mol C.(m+n-2)w/m mol D.(m-n-2)w/m mol
14.一定温度下,可逆反应2NO2 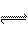 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。
A.①④⑤⑥ B.②③⑤⑥ C.①③④⑥ D.全部
13.右图装置中久置后铁片会被腐蚀,有关此装置的叙述中正确的是
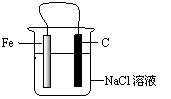 A.铁片为正极,碳棒为负极
A.铁片为正极,碳棒为负极
B.铁被腐蚀,碳棒上有氯气放出
C.碳棒附近的溶液可使酚酞变红
D.导线上有电流通过,电流方向是由铁极流向碳极
12.足量的Fe粉与一定量的盐酸反应,反应速率太快,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的
A.NaNO3溶液 B.水 C.NaCl溶液 D.CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com