
题目列表(包括答案和解析)
27.(6分)原子序数大于4的主族元素X、Y的离子Xm+、Yn-,它们的核外电子排布相同。据此可推知:X和Y所属周期之差为 ,X和Y的核电荷数之差为 ,(用m、n的代数式表示下同),Y和X的族序数之差为
26.(6分)RO3n-和S2-在一定条件下发生反应的离子方程式为,RO3n-+3S2-+6H+=R-+3S+3H2O,则(1)在RO3n-中R的化合价是 (2)R原子的最外层电子数是
(3)比较R-与S2-的还原性
24.某电池的总反应离子方程式为Cu2++Fe=Fe2++Cu,能实现该反应的是
A 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
B 阴极为Ag,阳极为Fe,电解质溶液为CuSO4溶液
C 正极为Cu,负极为Fe,电解质溶液为CuSO4溶液
D 正极为石墨,负极为Fe,电解质溶液为Fe2(SO4)3溶液
25

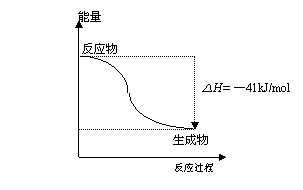 .已知一定条件下,
.已知一定条件下,
CO(g) + H2O (g) = CO2(g) + H2(g)
反应过程能量变化如图所示,下列有关该反应的说法正确的是
A、该反应为吸热反应
B、1mol CO(g)与1mol H2O(g)所具有的总能量大于1mol CO2(g)与1mol H2(g)所具有的总能量
C、反应的热化学方程式是:
CO(g) + H2O (g) = CO2(g) + H2(g);△H=+41kJ/mol
D、1mol CO2(g)和1mol H2(g)反应生成1molCO(g) 和1mol H2O(g)要放出41kJ热量
23.电解CuSO4溶液时,要求达到三点(1)阳极质量减少(2)阴极质量增加(3)电解质溶液中C(Cu2+)不变,则可选用的电极是
A 纯钢作阳极,含Zn、Ag的铜合金作阴极 B 用纯铁作阳极,纯铜作阴极
C 含Zn、Ag的铜合金作阳极,纯铜作阴极 D 用石墨作阴极,纯铜作阳极
22.A、B、C为三种短周期元素,A、B同周期;A、C的最低价离子分别为A2-、C-,其离子半径A2->C-。B2+与C-具有相同的电子层结构,下列叙述不正确的是( )
A 原子序数:A>B>C B 原子半径:C>A>B
C 离子半径:A2->C->B2+ D 原子最外层电子数:C>A>B
21.下列说法正确的是( )
A.同周期ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅦA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属的氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
20.下列说法正确的是( )
A在周期表中,族序数都等于该族元素的最外层电子数
B非金属性最强的元素,其最高价氧化物对应的水化物的酸性最强
C同周期的主族元素从左到右原子半径逐渐减小,它们形成简单离子的半径逐渐增大
D 碱金属随原子序数的增大,其熔沸点逐渐降低;卤素单质随原子序数的增大,其熔沸点逐渐升高
19.用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,其中不宜加入的物质是
A Na2SO4 B NaCl C CuSO4 D KOH
18.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd + 2NiOOH + 2H2O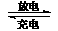 Cd(OH)2
+ 2Ni(OH)2
Cd(OH)2
+ 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
17.下列说法中错误的是①元素的相对原子质量是该元素一个原子的质量与12C原子质量的1/12的比值②16O、17O、18O、氧气、臭氧都是氧的同位素③所有元素的原子核都是由质子和中子组成的④凡同种元素的原子具有相同的质子数和中子数⑤含有相同质子数的微粒一定属于同种元素( )
A ④⑤ B只有② C只有⑤ D ①②③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com