
题目列表(包括答案和解析)
10、烷烃分子可以看做由以下基团组合而成:-CH3、-CH2-、-CH-、-C-
若某烷烃分子中同时存在这四种基团,则该烷烃至少含有的碳原子数应是( )
A.6 B.7 C.8 D.10
9、 一定条件下有可逆反尖:x(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),达到平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断中不合理的是( )
一定条件下有可逆反尖:x(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),达到平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断中不合理的是( )
A.c1:c2=1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率相等 D.c1的取值范围为0<c1<0.1mol·L-1
8、已知:4NH3+5O2===4NO+6H2O,若反应速率分别用v(NH3) 、v(O2) 、v(NO) 、v(H2O)
(mol·L-1·min-1)表示,则正确的关系是( )
A.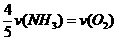 B.
B.
C.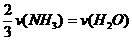 D.
D.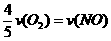
7、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质溶液的燃料电池中发电,电池正极反应为( )
A.H2+2OH--2c-===2H2O B.O2+4H++4e-===2H2O
C.H2-2e-====2H+ D.O2+2H2O+4e-===4OH-
6、一定量的H2在一定条件下完全燃烧后,生成气态H2O,放出热量Q1,等质量的H2在相同条件下完全燃烧生成液态H2O,放出热量Q2,则Q1和Q2的关系是( )
A.Q1> Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
5、碱性电池具有容量大,放电电流大的特点,因而得到广泛应用,锌-锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。下列说法中错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
4、A、B、C三种元素的原子序数依次a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是( )
A.a>b>c B.a>c>b C.a=b+m+n D.a=c-n-m
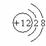
1.月球中的每百吨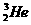 聚变所释放出的能量相当于目前人类一年消耗的能量;地球上氦元素主要以
聚变所释放出的能量相当于目前人类一年消耗的能量;地球上氦元素主要以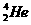 的形式存在。下列说法中正确的是( )
的形式存在。下列说法中正确的是( )
A.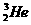 比
比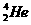 多一个中子
B.氦原子的质量数一定为3
多一个中子
B.氦原子的质量数一定为3
C.一个氦气分子中含有两个氦原子
D.氦(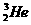 )气的摩尔质量为3g·mol-1
)气的摩尔质量为3g·mol-1
|
|
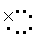
A.氯化钠的电子式为Na Cl B.镁的原子结构示意图为

|
D.重水的化学式为 (或D2O)
(或D2O)
|
A.NH4Cl=====NH4↑+HCl↑ B.NH3+CO2+H2O====NH4HCO3
C.2NaOH+Cl2==== NaCl+NaClO+H2O D.2Na2O2+2CO2==== 2Na2CO3+O2
29.(12分)已知X元素的原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性(用化学式表示) >
(2) 用电子式表示X和W形成化合物的过程
(3)X单质在空气中加热生成的化合物的电子式
(4)X和Z的最高价氧化物对应水化物反应的离子方程式
(5)W的低价氧化物与Y单质的水溶液反应的化学方程式
(6)已知3.2gW单质燃烧后放出15.8KJ的热量,写出表示W单质燃烧热的热化学方程式
(7)Y与Z形成化合物的化学式是 。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有 键(填离子或共价)
28.(11分)天然气(主要成分甲烷)是一种清洁、高效的能源,现在许多城市家庭用于厨房使用的燃料已经由煤气(主要成分是H2和CO按体积比1︰1混合的气体混合物)换成了天然气;此外天然气也是很好的燃料电池的燃料,甲烷在燃料电池中的能量转换率可达到85%-90%。请回答下列问题:
⑴已知H2、CO和CH4的燃烧热分别是286kJ/mol、283 kJ/mol和890 kJ/mol,则反应2CH4(g)+3O2(g)=CO(g)+H2(g)+CO2(g)+3H2O(l)的反应热 △H= 。
⑵以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。随着反应的不断进行溶液的碱性 (填“增大”“减小”或“不变”)。
⑶如果以该燃料电池为电源、石墨作两极电解饱和食盐水,则该电解过程中阳极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的C(OH-)=10-2mol/L,则理论上消耗甲烷在标准状况下的体积为 mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com