
题目列表(包括答案和解析)
24.有下列四种微粒:①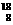 O、②
O、②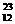 Na、③
Na、③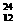 Mg、④
Mg、④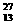 Al ,请用序号填写下列空格:
Al ,请用序号填写下列空格:
(1)按原子半径由大到小顺序排列为__________________________;
(2)按离子半径由大到小顺序排列为__________________________;
(3)微粒中质子数等于中子数的是______________________________;
(4)能形成X2Y2型化合物的是__________,能形成X3Y2型化合物的是__________。
23.元素周期律是指元素的性质随___________的递增,而呈_______性变化的规律,
这里元素的性质主要是指_____________和_____________;元素性质周期性变化
是______________________呈周期性变化的必然结果。 是元素周
期律的具体表现形式,主族元素的最高正化合价一般等于其 电子
数,非金属元素的负化合价等于 ;同一周期中,从左
到右,金属性逐渐 ,非金属元素逐渐 ;同一主族中,从
上到下,金属性逐渐 ,非金属元素逐渐 ;金属性最强
的元素是 ,非金属元素最强的元素是 (不考虑放射性元素)。
22.在原子序数1-18号元素中:(用化学符号填空)
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)在室温下有颜色的气体单质是_____________。
(4)除稀有气体外,原子半径最大的元素是_________,
(5)原子半径最小的元素是_____________。
(6)气态氢化物水溶液呈碱性的元素是_____________。
(7)气态氢化物最稳定的化学式是_____________。
(8)最高价氧化物对应水化物的酸性最强的元素是_____________。
(9)18号元素的原子结构示意图是 。
21.下列离子方程式中,错误的是
A.碳酸氢钙跟盐酸反应:H++ HCO3- = H2O+CO2↑
B.钠投入水中:2Na+2H2O=2Na++2OH-+H2↑
C.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.硝酸银溶液跟盐酸作用:Ag++Cl-=AgCl↓
(以上卷不交,请保留好,以便试卷讲评)
2010―2011学年度第二学期期中考试
高一化学(第II卷)
20.下列实验室中分离或除杂质的方法中不正确的是
A.用升华法分离碘和碘化钠固体混合物
B.用加热法除去纯碱固体中混有的小苏打
C.用饱和氯化钠溶液除去混在氯气中的氯化氢气体
D.用萃取法除去碘酒中的碘单质
19.下列物质中,既能与盐酸又能与烧碱溶液反应的是
A.Na2CO3 B.NaHCO3 C.Al2O3 D.Al(OH)3
个且正确的给2分,错选或不选为0分)
18.在一定条件下,RO3n-和氟气可发生如下反应:
RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
17.根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br-,判断下
列离子的还原性由强到弱的顺序是
A.Br-、Fe2、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
16.下列说法正确的是
A.在周期表中,族序数都等于该族元素的最外层电子数
B.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
C.碱金属随原子序数的增大,其熔沸点逐渐降低
D.卤素单质随原子序数的增大,其熔沸点逐渐升高
15.氢化锂是一种离子化合物,其中锂元素是+1价,氢化锂与水反应放出氢气。下列
叙述正确的是
A.在氢化锂中,H -离子半径比锂离子半径小
B.在氢化锂中,H -的电子排布与氦原子相同
C.氢化锂与水反应后,在反应液中滴入紫色石蕊试液显红色
D.氢化锂与水反应时,H -被还原为氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com