
题目列表(包括答案和解析)
26.(6分)(答案均保留3位有效数字)
已知在25ºC、1.013×105Pa下,1 mol CH4充分燃烧(C转化为CO2气体,H转化为液态水)放出的热量为890 kJ;使1 kg水的温度升高1 ºC需热量4.18 kJ。
(1) 1 m3(标准状况)甲烷在25ºC、1.013×105Pa条件下充分燃烧(生成CO2气体和液态水),释放出的热能是多少kJ?
(2)若用1 m3(标准状况)甲烷在25ºC、1.013×105Pa条件下充分燃烧所释放的热能加热温度为25ºC的水,若热量损失为20%,可使多少千克水沸腾?
2010~2011学年度第二学期期中试卷
25.(6分) 在由铜片、锌片和150 mL稀硫酸组成的原电池中,当在铜片上放出6.72 L(标准状况)的H2时,硫酸恰好用完,则:
(1) 产生这些气体消耗的锌的质量是 g;
(2) 通过导线的电子的物质的量是 mol;
(3) 该原电池正极的电极反应式为 。
24.(3分) +2价金属元素M的原子中质子数比中子数少2个,2.1g的单质M与足量的盐酸反应共产生氢气0.05mol。试通过计算确定:
(1)该元素的摩尔质量为 g/mol,
(2)用 形式表示上题中金属元素M的原子
。
形式表示上题中金属元素M的原子
。
23.已知非金属单质硫(S)是淡黄
色固体粉末,难溶于水。为了验
证氯元素的非金属性比硫元素的
非金属性强,某化学实验小组设
计了如下实验,请回答下列问题:
(1) 装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用 。
(3) 装置B中盛放的试剂是 (此空选填下列所给试剂的代码),实验现象为 ,化学反应方程式是 , 该反应属于四种基本反应类型中的 反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4) 还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。 。
(5) 装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由。
22.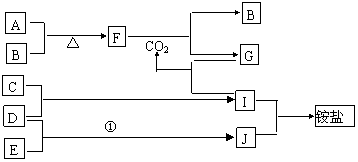 下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
(1)用化学式表示下列物质
A C E G J
(2)写出下列物质间反应的化学方程式
A和B:
F和CO2:
D和E:
(3)写出G和I反应的离子方程式: 。
21.有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)D元素位于周期表中 周期 族。
(2)写出C2B的水化物与Al(OH)3反应的离子反应方程式 。
(3)画出B的原子结构简图 ___________________。
(4)电子式表示化合物 C2D 的形成过程: 。
20.将锌片和铜片用导线连接后放入稀硫酸溶液中发生原电池反应,下列叙述正确的是
A.SO42- 向负极区域移动 B.正极有O2逸出
C.电子通过导线由铜片流向锌片 D.铜片上有H2逸出
第II卷 主观卷(共55分)
19.实验室准备较快地制取氢气,可采用的方法是
A.用纯锌与稀硫酸反应
B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反应
D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应。
18.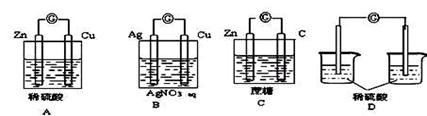 下列各装置能构成原电池的是
下列各装置能构成原电池的是
17.在反应H2 + Cl2 = 2HCl中,已知断开1 mol H-H需要吸收436 kJ的能量,断开
1 mol Cl-Cl需要吸收243 kJ的能量,断开1 mol H-Cl需要吸收431 kJ的能量,判断该反应是
A. 吸热反应 B.放热反应
C.放出862 kJ热量 D.放出183 kJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com