
题目列表(包括答案和解析)
2.氧化还原反应的基本概念
Ⅰ氧化剂和还原剂
氧化剂和还原剂指的是具体反应中的反应物,而氧化反应和还原反应分别指的是还原剂和氧化剂发生的化学变化.
还原剂:失(失去电子)→高(化合价升高)→氧(发生氧化反应);
氧化剂:得(得到电子)→低(化合价降低)→还(发生还原反应).
Ⅱ氧化性和还原性
通常氧化剂具有氧化性.若某物质得到电子能力强,则该物质氧化性较强.较难得到电子的氧化剂氧化性较弱.还原性是指还原剂在反应中失去电子的难易程度.易失去电子的还原剂,有较强的还原性,较难失去电子的还原剂,则还原性较弱.如钾比铜易失去电子,所以钾的还原性强,铜的还原性弱.值得注意的是氧化性、还原性的强弱,取决于原子得失电子的难易程度,而不是原子得失电子的多少.
Ⅲ氧化产物和还原产物
氧化剂发生还原反应所得的生成物叫做还原产物.还原剂发生氧化反应所得的生成物叫做氧化产物.这两者都是指反应后的生成物.氧化剂具有氧化性,发生还原反应,生成还原产物.还原剂具有还原性,发生氧化反应,生成氧化产物.
随堂练习 知识巩固
1.金属性和非金属性
“金属性”是原子失去电子能力的大小.一般可以通过单质和水(或酸)反应生成H2的难易程度及最高价氧化物对应水化物的碱性强弱来确定,如:Na和冷水反应生成H2、Mg和热水反应生成H2、Al和水在高温条件下反应生成H2,所以金属性的强弱为:Na>Mg>Al;NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物,所以碱性的强弱为:NaOH>Mg(OH)2>Al(OH)3.
“非金属性”是指原子得到电子能力的大小.一般可以通过对应的气态氢化物的稳定性及最高价氧化物对应水化物的酸性强弱来确定,如:P、S、Cl元素,气态氢化物的稳定性为:PH3<H2S<HCl;最高价氧化物对应水化物的酸性的强弱为:H3PO4< H2SO4<HClO4,所以非金属性的强弱为:P<S<Cl.
3.通过对钠有关性质的实验,培养观察能力和思维能力.
本节重点:钠的化学性质.
本节难点:钠与水反应的一系列现象的观察与描述.
教材解读精华要义
相关链接
2.区分元素存在的游离态和化合态两种形态,明确钠在自然界中只能以化合态存在的原因.
1.了解钠的物理性质和用途,掌握钠的化学性质,认识到钠是一种活泼的金属.
4.做钠与水反应的实验时,试管中为什么不能有气体?把试管往上提起时,如果试管口露出水面会有什么情况发生?
点拨 试管中混入气体.当点燃氢气时.会发生爆炸.把试管往上提起时,如果试管口露出水面,会使空气混入试管中,使收集到的氢气不纯.
(2)钠与水的反应实验也可按以下方法进行
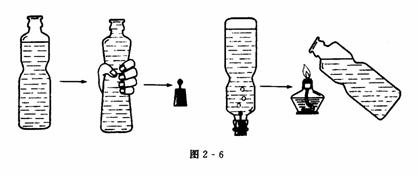
①在空塑料瓶中加入约3/4体积的水,用手挤压瓶子,使水面上升至近瓶口,排走瓶中的大部分空气后.在胶塞上固定一根大头针,用针扎起一块黄豆粒大小的金属钠,迅速用胶塞塞住挤瘪的瓶口,倒置.待反应完全后,反应产生的气体使挤瘪的瓶子复原,取下塞子,迅速用拇指堵住瓶口,并将瓶口移近火焰(如图2-6所示),可听到有爆鸣声,证明钠与水反应产生的气体是氢气.
② 取一只250mL的广口瓶,加水150mL,滴入2-3滴酚酞试液.与前面操作相同,把一只漏斗倒罩在瓶口上,再在漏斗颈上套一支小试管,用向下排空气法收集反应生成的气体.装置如图2-7所示.也可用如图2-8所示的装置,然后用排水法收集氢气.
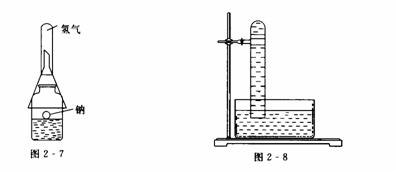
③向试管里加入半管水,滴入2 mm-3 mm厚的一层煤油.切取一小块金属钠,将它用镊子夹入试管内.钠虽然沉到煤油层下,但是浮于水面,钠块顶部仍露出煤油层.通过放大镜从试管的侧面观察实验现象.如图2-9所示.此法比将金属钠直接投入水中发生的反应缓慢得多.

知识规律小结 金属钠与水的反应类型
①用四种基本反应类型的分类方法分析
金属钠与水的反应,其反应的“基本类型”属于置换反应--由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应.
置换反应并不只限于金属与酸之间的反应.我们已经学过的置换反应有以下几种:
金属与酸之间的反应,如:Zn+2HCl=ZnCl2+H2↑;
氢气与氧化铜的反应,如:CuO+H2
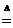 Cu+H2O;
Cu+H2O;
活泼金属与水的反应,如:2Na+2H2O=2NaOH+H2↑.
钠与水反应的本质是钠与水电离出的极少量的H+之间的反应.可见,水也是一种电解质,但是是一种极弱的电解质.
依据离子方程式的书写规则,金属钠、水、氢气在离子方程式中应仍用化学式表示,易电离、易溶于水的氢氧化钠则写成离子形式.有关的离子方程式为:
2Na+2H2O=2Na++2OH-+H2↑
②用是否有电子转移的分类方法分析
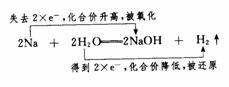
在金属钠与水的反应中,钠原子失去1个电子成为钠离子,水分子中的氢得到1个电子,并两两结合成为H2.这一有电子转移(得失或偏移)的反应是氧化还原反应. 在反应中,还原剂钠失去电子,反应时钠元素的化合价升高;氧化剂水是得到电子的物质,在反应时所含氢元素的化合价降低.有关反应可表示为:
Ⅳ与酸反应
钠与酸的反应比与水的反应重剧烈,极易爆炸,要特别小心.
2Na+2HCl=2NaCl+H2↑
[注意] 钠和水反应就是钠与水电离出来的氢离子反应,酸在水中电离出氢离子,所以钠和酸直接反应,而不是先和水反应生成氢氧化钠后再和酸反应.
思维拓展 已知金属钠与稀盐酸的反应要比与水的反应更加剧烈,有趣的是,金属钠与浓盐酸的反应反而不如与水反应剧烈,并伴有大量沉淀生成.请你给出这种现象的合理解释.
点拨 在金属钠与浓盐酸的反应中,在钠与液体接触的地方生成大量氯化钠,由于氯化钠在浓盐酸中的溶解度较小,难于迅速溶解,对溶液与金属钠的进一步接触起到了一定的阻碍作用,使反应的剧烈程度降低.
小结 钠与水和酸反应的实质
钠与水或酸溶液的反应,实质上是把钠形成钠离子时所失去的电子转移给水或酸所电离产生的H+.当钠与酸溶液反应时,溶液中的H+基本来源于酸的电离.一定要弄清钠先与酸反应还是先与水反应,对此的解答是:
在钠与酸溶液反应时,我们永远无法分清所参与的H+是来源于酸的电离还是水的电离.酸与水的电离能力是大不相同的,但它们电离所产生的H+是完全一样的.如果一定要从物质角度去分析,可以认为:既然酸溶液中的H+基本上来源于酸,钠当然先与酸反应.
因为酸溶液中的H+浓度比水中的H+浓度大得多,所以钠与酸溶液的反应比钠与水的反应要剧烈得多,常使钠与氢气发生燃烧或产生轻微的爆炸.
Ⅴ与盐溶液反应
钠与硫酸铜溶液的反应:由于金属钠很活泼,它与硫酸铜溶液的反应比较复杂.这个反应除了与钠跟水的反应有类似现象外,还产生蓝色沉淀,有时还会有黑色物质产生,一般无红色物质(金属铜)产生.这是因为在一般情况下,钠与硫酸铜溶液(特别是稀溶液)相遇,钠主要先与水反应(实际与H+反应)产生氢气和氢氧化钠,硫酸铜与氢氧化钠作用生成蓝色沉淀氢氧化铜,又因前一反应是放热的,一部分氢氧化铜受热会分解,生成黑色的氧化铜.有关反应的化学方程式如下:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
Cu(OH)2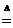 CuO+H2O
CuO+H2O
总反应的化学方程式可表示为:
CuSO4+2Na+2H2O=Cu(OH)2↓+Na2SO4+H2↑
[说明] 钠和盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子的形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触.将钠加入到盐的水溶液中,首先是钠和水反应,若氢氧化钠和盐反应生成难溶的碱,则氢氧化钠和盐反应;否则只有钠与水的反应.
小结 钠和盐的反应
①钠投入到CuSO4溶液中:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
②钠投入到NaCl溶液中只与水反应:
2Na+2H2O=2NaOH+H2↑
③钠投入到NH4Cl溶液中:
2Na+2H2O=2NaOH+H2↑(放热)
NH4Cl+NaOH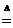 NH3↑+H2O+NaCl
NH3↑+H2O+NaCl
④钠投入到TiCl4熔融盐中:
4Na+TiCl4=4NaCl+Ti
知识点5 金属钠的制法
电解熔融NaCl制取单质钠:
2NaCl(熔融) 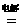 2Na+Cl2↑
2Na+Cl2↑
知识点6 金属钠的用途
Ⅰ制各种钠的化合物,如过氧化钠等.
Ⅱ制钠钾合金,钠钾合金为液态,是原子反应堆的导热剂.
Ⅲ还原多种金属,金属钠能把钛、锆、铌、钽等金属从它们的卤化物中置换出来.如:
4Na+CiCl4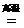 4NaCl+Ti 还原性:Na>Ti
4NaCl+Ti 还原性:Na>Ti
Na+KCl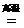 NaCl+K↑ 沸点:Na>K
NaCl+K↑ 沸点:Na>K
Ⅳ应用在电光源上,制高压钠灯.高压钠灯现在已大量应用于道路和广场的照明.由于它不降低光照强度又能减少能源消耗,所以有取代高压汞灯的趋势.早在1950年就在实验室中解决了钠蒸气的气体放电发光问题,但由于需要解决在高温、高压下钠蒸气有很强的腐蚀性的问题,直到1965年才制出了第一盏高压钠灯.高压钠灯虽然问世较晚,但发展很快.钠灯也可用于洗相的暗室,因为这种黄光不会使相纸曝光.
典例剖析 经典例题
基本概念题
有关基本概念的题目主要包括:钠的物理性质和用途;钠与水、O2等反应的现象;有关钠与水、O2等反应的简单计算等.
例1 把金属钠投入水中,所观察到的实验现象是_________,它反映了钠的哪些物理性质?
(分析) 金属钠投入水中,观察到的实验现象可用5个字来概括;“浮、熔、游、嘶、气”,即钠浮在水面上,熔化成一个闪亮的小球,小球在水面上不断游动,发出“嘶嘶”的响声,体积不断变小,并有气体产生.这些实验现象反映了钠是密度小、熔点低、具有银白色金属光泽的金属.此外,“游、嘶、气”说明钠与水反应剧烈,迅速生成氢气,由于反应剧烈,同时可听到“嘶嘶”的响声,看到有气体产生(反应放热,使水蒸发,与反应生成的H2一起逸出,故可能观察到“袅袅白烟”).
答案:钠浮在水面上,熔化成一个闪亮的小球,小球在水面上不断游动,发出“嘶嘶”的响声,体积不断减小,并有气体产生;反映了钠密度小、熔点低,闪亮的小球说明钠是具有银白色金属光泽的金属
例2 金属钠的用途有:①作还原剂还原某些金属;②制高压钠灯;③制取过氧化钠;④制取钾钠合金,用作原子反应堆的导热剂.其中属于利用钠的物理性质的是 ( )
A.①② B.①③
C.②④ D.④
3.在反应后的水溶液里加入酚酞试液,显红色,这是为什么?
点拨 钠与水反应生成氢气和氢氧化钠,使溶液呈碱性,所以酚酞显红色.
2.钠投入水中有哪些主要现象?这说明钠具有哪些性质?
点拨 金属钠熔化成闪亮的小球,在水面滚动并发出“嘶嘶”的响声,不久小球消失.钠浮在水面上,说明钠的密度比水小;钠能与水剧烈反应,且是放热反应,放出的热量使未反应的金属钠熔化成液态形成小球状,这也说明钠的熔点较低;由于钠浮在水面,表面接触部位先发生反应,放出的氢气推动小球游动,但受力不均故小球不断滚动.由于水遇到熔融的小球迅速汽化而发出声音.
1.能用小刀切开金属钠,截面的色泽很快消失,这说明什么?
点拨 说明金属钠很软.钠表面呈银白色光泽.由于钠的化学性质很活泼,表面很快被氧化而失去光泽变暗.
1.为了增强直观性,加大可见性,也可用两块玻璃片,中间放一块去掉表皮,干净的钠,然后用力挤压,形成钠的一个大薄片。观察钠的光泽与颜色,效果较好.
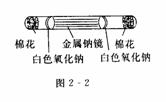 2.截取一根15 cm长的薄壁玻璃管,一端熔光,一端保留锋口.在白瓷板上将钠块的外皮切除后移置于洁净的滤纸上.左手用镊子夹住钠块,右手将玻璃管锋利的一端按在钠块中央,如同钻孔一样边旋边下压,使截切下来的金属钠进入玻璃管内,再用玻璃棒将它推至管的中部并压紧,玻璃管的两端用棉花塞紧(如图2-2所示).这样制得的样品能保留数天.因被空气里的氧气氧化,钠块的两端首先生成
2.截取一根15 cm长的薄壁玻璃管,一端熔光,一端保留锋口.在白瓷板上将钠块的外皮切除后移置于洁净的滤纸上.左手用镊子夹住钠块,右手将玻璃管锋利的一端按在钠块中央,如同钻孔一样边旋边下压,使截切下来的金属钠进入玻璃管内,再用玻璃棒将它推至管的中部并压紧,玻璃管的两端用棉花塞紧(如图2-2所示).这样制得的样品能保留数天.因被空气里的氧气氧化,钠块的两端首先生成
白色的氧化钠,而中间部分仍光亮如镜,以舌氧化层逐渐向中心扩展,直至钠块全部被氧化.
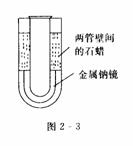 3.取两支口径和长短不等的试管.使小的能套在大的中间并可自由滑动.在白瓷板上切下一小块除去外皮的金属钠,将它放入大试管里后浸在热水中加热.待试管里的钠熔化后立即将小试管套入并轻轻挤压,使熔化的钠填充在两管壁间.从热水中移出,待冷凝后往试管壁间的空隙里注入熔化的石蜡.这样制得的样品(如图2-3所示)能使钠的真面目保留更长的时间.
3.取两支口径和长短不等的试管.使小的能套在大的中间并可自由滑动.在白瓷板上切下一小块除去外皮的金属钠,将它放入大试管里后浸在热水中加热.待试管里的钠熔化后立即将小试管套入并轻轻挤压,使熔化的钠填充在两管壁间.从热水中移出,待冷凝后往试管壁间的空隙里注入熔化的石蜡.这样制得的样品(如图2-3所示)能使钠的真面目保留更长的时间.
小结 钠是银白色的金属,有良好的导电性和传热性,密度为0.97 g/cm2,比水的密度还小,所以能浮在水面上,熔、沸点低(熔点97.81℃,沸点882.9℃),硬度很小(能用小刀切开).
知识点4 钠的化学性质(重点)
钠是活泼的金属单质,化学性质非常活泼,能够与多种物质反应。钠单质主要表现还原性.
Ⅰ钠跟氧气的反应
实验2-2:钠与氧气的反应实验
实验目的:认识钠与氧气的反应.
实验原理:4Na+O2=2Na2O 2Na+O2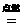 Na2O2
Na2O2
实验用品:钠、酒精灯、石棉网、铁架台、火柴
实验步骤:(1)将金属钠用小刀切开,在空气中放置一会儿,可看到表面逐渐变暗,生成的主要产物为氧化钠.
 (2)再另取一小块金属钠,擦干表面的煤油后、放在石棉网上加热,直至燃烧(如图2-4所示).燃烧时,火焰呈黄色,最后生
(2)再另取一小块金属钠,擦干表面的煤油后、放在石棉网上加热,直至燃烧(如图2-4所示).燃烧时,火焰呈黄色,最后生
成了淡黄色粉末--过氧化钠.
实验结论:钠很容易被氧化,在常温下就能够跟空气里的氧气化合而生成氧化物.切开的光亮的金属断面很快就发暗,主要
是因为生成了一薄层氧化物.钠受热以后能够在空气里着火燃烧,在纯净的氧气里燃烧得更为剧烈,燃烧时发出黄色的火焰.
钠跟氧气反应可以生成氧化钠,氧化钠不稳定。钠跟氧气剧烈反应生成过氧化钠,过氧化钠比较稳定.钠在空气里燃烧,生成的
是过氧化钠.
在空气中缓慢氧化使钠表面变暗:
4Na+O2=2Na2O
在空气或氧气中燃烧,生成淡黄色固体:
2Na+O2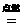 Na2O2(有黄色火焰,生成过氧化钠)
Na2O2(有黄色火焰,生成过氧化钠)
[注意] ①钠敢在石棉网上片刻后再加热,有利于观察现象;
②石棉网要干燥、石棉无破损;
③石棉网的石棉要洁白,否则不易观察到Na2O2的浅黄色;
④石棉网要放平,防止钠滚下石棉网.
小结 钠和氧气的反应如下表
钠和氧气的反应情况
|
实验操作步骤 |
实验现象 |
实验结论及反应 |
|
用小刀切一小块金属钠 |
银白色光亮切面 |
钠是银白色质软的金属 |
|
放置片刻 |
光亮切面变暗 |
常温下钠易与氧气反应 4Na+O2=2Na2O |
|
放在石棉网上加热 |
剧烈燃烧,发出黄色火焰,生成淡黄色固体 |
钠易燃烧,产物不是氧化钠 2Na+O2 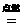 Na2O2 Na2O2 |
[说明]①钠与氧气反应,条件不同,产物不同:不加热,生成氧化钠;点燃,生成过氧化钠.
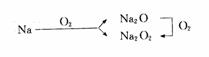
a.条件:常温缓慢氧化→Na2O;加热燃烧→Na2O2.
b.火焰:黄色火焰.
②钠长期露置空气中的变化:
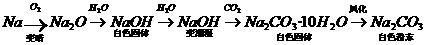
有关反应如下:
4Na+O2=2Na2O
Na2O+H2O=2NaOH
2NaOH+CO2=Na2CO3+H2O
Na2CO3·10H2O=Na2CO3+10H2O
思维拓展 实验室如何制备氧化钠(Na2O)?
点拨 由于钠与氧气反应易直接生成过氧化钠,故在实验室制取氧化钠时常采用其他方法.
6Na+2NaNO2=4Na2O+N2
Ⅱ钠跟硫等非金属的反应
钠除了能跟氯气直接化合外,还能跟很多其他非金属直接化合,如跟硫化合时至发生爆炸,生成硫化钠.
取一只广口瓶,在瓶底厚厚铺一层细沙.将钠块用镊子夹入刚加热过的燃烧内,待钠熔化时加入少量硫粉,迅速把燃烧匙插至广口瓶底,浅埋在细沙里.反应起较缓慢,然后逐渐加剧,不久就会着火燃烧,火星飞溅.
2Na+S=Na2S(爆炸)
2Na+Cl2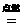 2NaCl(苍白色烟)
2NaCl(苍白色烟)
Ⅲ钠跟水的反应
实验2-3:钠跟水的反应实验
实验目的:认识钠与水的反应.
实验原理:2Na+2H2O=2NaOH+H2↑
实验用品:钠、水、酚酞、烧杯、试管、镊子、酒精灯、火柴
实验步骤:(1)向一盛水的烧杯中滴入几滴酚酞试液,然后将一小块钠(约为1/2豌豆大小)投入烧杯中.
(2)再用铝箔将一小块钠(绿豆大)包好,并在铝箔上刺些小孔,用镊子夹住,放在烧杯中试管口下面(如图2-5所示),用排水法收集一小试管气体,小心移近火焰,点燃.
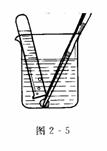 实验现象:可看到钠“浮”于水面(钠的密度小于水的密度),立即与水反应,并“熔”化成闪亮的小圆球(反应放热,钠的熔点低),小圆球迅速四处“游”动,并伴有“嘶嘶”的响声且最后消失(有气体产生),烧杯中的溶液由无色变为红色(有碱性物质氢氧化钠生成).点燃气体,可听到轻微的爆鸣声.(难点)
实验现象:可看到钠“浮”于水面(钠的密度小于水的密度),立即与水反应,并“熔”化成闪亮的小圆球(反应放热,钠的熔点低),小圆球迅速四处“游”动,并伴有“嘶嘶”的响声且最后消失(有气体产生),烧杯中的溶液由无色变为红色(有碱性物质氢氧化钠生成).点燃气体,可听到轻微的爆鸣声.(难点)
实验结论:钠跟水能起剧烈的化学反应.钠比水轻,投入烧杯中时,浮在水面上.钠跟水起反应放出的热,立刻使钠熔化成一个闪亮的小球.小球向各个方向迅速移动,并逐渐缩小,最后完全消失.钠跟水起反应后,烧杯里的溶液由五色变为红色.这个现象说明有新的物质生成,这种生成物就是氢氧化钠.试管里收集到的气体是氢气.
(1)钠与水反应的实验总结
钠与水反应的实验总结
实验操作步骤实验现象
|
实验操作步骤 |
实验现象 |
结论 |
|
一小块钠,擦去表面的煤油,投入装入少量水的烧杯中 |
①
钠浮在水面上;②钠溶化成闪亮的小球;③钠向各个方向游动;④反应伴有“嘶嘶”的响声;⑤钠最后消失 |
①
钠的密度比水小;②钠与水反应放热,钠的熔点低;③钠和水反应有气体生成,推动钠游动;④反应很剧烈 |
|
向水中加入酚酞 |
变红色 |
有NaOH生成 |
|
另外用排水法收集生成的气体,移近火焰点燃 |
轻微爆鸣声 |
有H2生成 |
|
化学方程式 |
2Na+2H2O=2NaOH+H2↑ |
|
|
离子方程式 |
2Na+2H2O=2Na++2OH-+H2↑ |
[注意] 在包裹钠块的铝箔上要多刺几个小孔,钠粒不能过大,否则,铝箔包会因内部气压大、温度高而发生爆炸;在将盛有氢气的试管移向酒精灯点火的过程中,要将试管口用手的拇指堵严,防止氢气逸出使实验效果不明显.
思维拓展 把贮存在煤油里的金属钠取出后,切取一小块投入水中.往反应后的水溶液中加入酚酞试液,呈红色.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com