
题目列表(包括答案和解析)
碱金属
3.做好焰色反应的关键是什么?
点拨 做好焰色反应的关键是:铂丝要洗净,避免其他离予对实验的干扰;酒精灯的灯芯不能被污染,待测液的浓度不能太小.
2.在NaHCO3加热分解实验完成时,为什么要先将导管移出烧杯,然舌再熄灭酒精灯?
点拨 在完成加热NaHCO3的实验时,如果先熄灭酒精灯,再移去装有石灰水的烧杯会使烧杯内的冷水倒流而把试管炸裂.
[实验操作]①洗铂丝.把铂丝用盐酸洗涤后灼烧,反复多次,直至火焰呈无色.
[注意]若无铂丝,可用洁净无锈的铁丝代替.
②蘸粉末.用铂丝蘸一些KCl的混合粉末,放到酒精灯火焰上灼烧.
③观察.透过蓝色钴玻璃观察.
④再蘸粉末.分别蘸Na2CO3粉末或Na2CO3和KCl的混合粉末.观察混合粉末的焰色反应时,先直接观察,再透过蓝色钴玻璃观察.
[注意] ①做焰色反应实验时,溶液浓度较大为好,否则呈现的焰色很快消失.
②做焰色反应实验时最好用无色火焰,如煤气灯.
③每做一次实验,都要把铂丝重新用稀盐酸和蒸馏水反应洗净再在火焰上灼烧至五色.
④做焰色反应实验时,要在灯焰的外焰上灼烧化合物,使形成的火焰较长,现象明显.
⑤实验完毕,将铂丝放在盐酸中浸渍2 min-3 min,再用蒸馏水洗净,使它洁净无垢.
[实验现象]Na的焰色反应是黄色,K早紫色.灼烧Na2CO3和KCl混合粉末时,直接观察,看到火焰呈黄色,透过蓝色钴玻璃观察呈紫色.
[实验结论]钠、钾的焰色反应分别为黄色、紫色.
思维拓展
1.做钠与水反应的实验时,试管中为什么不能有气体?
点拨 试管中混入气体,当点燃氢气时,可能会发生爆炸.
[实验操作]①向两支试管中分别放入少量的NaHCO3和Na2CO3粉末.
②向两支试管中各加入少量的稀盐酸.
[实验现象]NaHCO3与盐酸的反应比Na2CO3与盐酸的反应剧烈.
[实验结论]Na2CO3与盐酸反应是分步进行的,首先是:Na2CO3+HCl=NaCl +NaHCO3,然后是:NaHCO3+HCl=NaCl+CO2↑+H2O.故NaHCO3与HCl反应时,马上就有气体放出;而Na2CO3与HCl反应,先生成NaHCO3,然后才有气体生成.
[实验操作]①连接装置并检查装置的气密性.
②放入1 g左右的NaHCO3,注意试管必须干燥.
③用带导气管的塞子塞住试管.
④固定.注意试管口要略向下倾斜,导气管的另·一端浸没在澄清的石灰水中.
⑤加热.先均匀受热再集中加热.
⑥撤除装置.先撤导气管再撤酒精灯,以防止倒吸.
[注意]①NaHCO3粉末在试管中应铺平,否则容易受热不均.
②当澄清的石灰水变浑浊时,应将盛石灰水的烧杯移去.
[实验现象]①试管内壁有水珠;②澄清的石灰水变浑浊.
[实验结论]NaHCO3受热分解生成了CO2和H2O:
2NaHCO3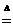 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
4.钠与O2的反应
[实验操作]①取一根较粗的玻璃管.
②将钠放在玻璃管中部.
③加热.
④将反应后的物质放入小试管.
⑤滴加2滴水.
⑥用带火星的木条检验放出的气体.
[实验现象]①钠受热熔化,并燃烧,试管中部的固体由白色变成黄色.
②加水后,反应剧烈、放热,生成的气体可使带火星的木条剧烈燃烧.
[注意] ①玻璃管不能太细,否则空气流量不够.
②所用钠块必须去掉表面的氧化物,否则燃烧耐会使试管壁显黑色,影响观察实验现象.
[实验结论]钠在空气中缓慢氧化生成Na2O,剧烈燃烧生成Na2O2,生成的Na2O2与水反应放出O2,有关的化学方程式如下:
4Na+O2=2Na2O(白)
2Na+O2 Na2O2(淡黄)
Na2O2(淡黄)
2Na2O2+2H2O=4NaOH+O2↑
3.钠与水反应(二)
[实验操作]①取烧杯和铝箔.向烧杯内加入容积的水,将铝箔刺一些小孔.
②切钠→用铝箔包好→用镊子夹住→置于盛满水的试管口下.
③试管中气体集满时,把试管口向下移近酒精灯,点燃.
[实验现象]①试管中气体燃烧,发出“噗”的一声;②溶液变红.
[实验结论]钠与水反应生成了NaOH和H2:2Na+2H2O=2NaOH+H2↑
[注意] ①可用水槽代替烧杯反复操作.
②实验之前要反复练习放入试管的操作直至熟练.否则操作时会有部分空气进入试管.
2.钠与水反应(-)
[实验操作]①向烧杯内倒八少量水.
②用镊子把切下的钠放入烧杯里.
③迅速盖上玻璃片.
④向反应完毕后的烧杯内加入几滴酚酞试液.
[实验现象]钠浮在水面上;②熔化成闪亮的小球;③钠向各个方向游动;④有“嘶嘶”的响声;⑤反应后的溶液可使酚酞变红.
[实验结论]①钠密度比水小;②Na与水的反应是放热反应,钠的熔点低;③有气体生成:④反应很剧烈;⑤溶液显碱性.
1.钠的取用.
(1)用镊子取一小块金属钠,用滤纸把钠表面的煤油擦干.
[注意] ①取用钠时要用镊子,不可用手拿.
②待用的钠要用滤纸吸净其表面上的煤油.
(2)用小刀切下绿豆大小的-块钠.
[注意] ①取用钠时不能用较大的钠块,因为钠的性质很活泼,它与水反应时放出大量的热,甚至可使周围的水沸腾,因此钠同时也跟水蒸气反应.如果在水面上游动的钠被容器壁上的油污黏住,不能游动,放出的热量不易扩散,会使氢气着火燃烧,最后还会发生小爆炸,使生成的NaOH溶液飞溅出来.
②钠为银白色、具有金属光泽的固体,硬度很低,非常柔软,可用小刀切开,断面是银白色.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com