
题目列表(包括答案和解析)
1.碱金属是一族金属元素,它们的原子结构的共同特点是次外层电子是8个(锂是2个)和最外电子层都只有1个电子,在化学反应中容易失去电子,因此它们都是活泼的金属元素,它们的化学性质基本相似.例如,它们的单质大多是银白色(铯略带金色)、硬度小、熔点较低、密度较小的金属,具有良好的延展性、导电性、导热性.它们的单质在化学反应中呈现出很强的还原性,能与大多数非金属化合,都能与水反应生成氢氧化物与氢气;它们的氧化物对应的水化物都是强碱.
碱金属的化学性质主要是具有很强的金属性,随着原子半径的增大,金属性增强.它们的单质都是强还原剂.
碱金属的化学性质
7.推断:有四种钾的化合物X、Y、Z、Q,其中Q中K元素所占的质量分数为70.9%,根据以下反应式判断X、Y、Z、Q的化学式.
A.X△→Y+H2O+CO2↑ B.Q+CO2→Y+O2
C.Q+H2O→Z+O2↑ D.Y+Ca(OH)2→Z+CaCO3↓
X是______;Y是______;Z是______;Q是_______.
答案: KHCO3;K2CO3;KOH;K2O2[提示:本题在思考时应将钠及其化合物的相互关系进行迁移,不难推出X为KHCO3,Y为K2CO3,Z为KOH,Q为K2O2]
章末总结
知识网络图示
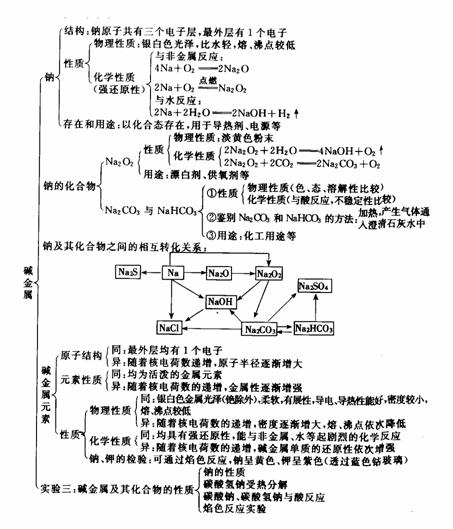
基本知识提炼整理
6.下列各组物质发生反应时,只能得到一种生成物的是 ( )
A.Na和O2 B.C和O2
C.Na和Cl2 D.CO2和NaOH
答案:C
5.鉴别下列各组物质,只能采用焰色反应的是 ( )
A.K2CO3和NaCl B.KCl和NaNO3
C.NaCl和MgCl2 D.NaCl和KCl
答案:D
4.用铂丝做焰色反应实验,每次用完后都需要 ( )
A.用水洗涤2-3次后再使用
B.用滤纸擦干净即可使用
C.用盐酸洗涤,再用自来水洗涤后即可使用
D.用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用
答案:D
3.按锂、钠、钾、铷、铯的顺序,下列性质逐渐减弱(或降低)的是 ( )
A.氢氧化物的碱性 B.单质的还原性
C.元素的金属性 D.单质的熔点
答案:D
2.下列不属于碱金属单质的通性的是 ( )
A.硬度小,密度小,熔点低 B.导电、导热性强
C.焰色反应的颜色相近 D.还原性较强
答案:C
1.下列关于碱金属化学性质的说法中,错误的是 ( )
A.它们都能在空气中燃烧生成M2O(M表示碱金属)
B.它们都能与水反应,生成碱和氢气
C.随着核电荷数的递增,元素的阳离子的氧化性逐渐增强
D.常温下都能与氧气发生反应
答案:AC
2.焰色反应
①钾的化合物中混有钠的化合物,灼烧时黄色光会遮住紫色光,观察钾或钾的化合物的焰色反应,要用蓝色的钴玻璃滤去黄色光.
②蘸取待测液的金属丝应选择无焰色反应的,如铂丝、铁丝、电炉丝等.
③铂丝等使用前要用盐酸洗涤,然后在火焰上灼烧至无色,因为盐酸是挥发性酸,且金属的氯化物灼烧时易汽化.
随堂练习 知识巩固
1.碱金属的共性、递变性和特性
(1)共性(M代表碱金属)
银白色金属(铯略带金色光泽),质软,有展性,熔点较低,密度较小,导电、导热性强;自然界中均以化合态存在,最外层有一个电子,具有很强的还原性,是典型的金属.
与卤素反应很剧烈;与氧气反应可生成氧化物、过氧化物、超氧化物;能跟水反应,生成氢氧化物并放出氢气;水溶液呈强碱性.
(2)递变性
①碱金属原子的电子层数增加,原子半径逐渐增大.
②密度:小→大(但其中钠、钾颠倒).Li的密度小于煤油,应保存在石蜡里.
③熔、沸点:高→低.
④金属性(还原性):越来越强.
⑤M与H2O、HCl反应越来越剧烈.
⑥MOH碱性越来越强.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com