
题目列表(包括答案和解析)
4.装液和赶气泡.向滴定管中注人水至“0”刻度以上2cm-3 cm处,将滴定管垂直夹持在滴定管夹上,如果滴定管尖嘴部分有气泡,应快速放液.以赶走气泡.调整液面到”旷刻度或”0”刻度以下.
[注意] ①在滴定管夹上,滴定管要垂直.
②如果滴定管尖嘴部分有气泡。一定要赶走它,使滴定管尖嘴内充满液体.
③由于滴定管的“0”刻度线以上没有其他刻度线.所以当滴定管尖嘴内的气泡赶走以后,要把管内液面调到”0”刻度或“0”刻度以下,但又不能离“0”刻度太远.
3.润洗,从滴定管夹L取卜滴定管。从滴定管上口倒入少量所要盛装的溶液(这里可用水代替),并使滴定管缓慢倾斜转动。使水润湿滴定管内壁.用左手控制活塞,将水从滴定管下部放出.再用水润洗滴定管一次.
[注意] ①在向滴定管里装入某种溶液之前,一定要先用少量该溶液将滴定管的内壁全部润洗2-3次,并且润洗液要从滴定管下部放出,使滴定管尖嘴内壁也得到润洗.
②润洗滴定管时要小心操作,以防碰破滴定管,也要防止润洗液洒落.
2.控制活塞,取一支洁净的酸式滴定管,将滴定管固定在滴定管夹上.用左手控制滴定管的活察(如图1-31所示),并轻轻地反复转动活塞,使活塞转动灵活.
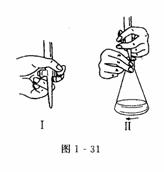
[注意] ①手势:左手食指、中指在前,拇指在后(如图1-3lⅠ所示).
②转动滴定管的活塞时,不要向一边推或拉滴定管,也不要向下拽滴定管.
③滴定管的活塞要转动灵活,若转动不灵活,要向教师请教解决办法.
1.构造(如图1-30所示).滴定管是内径均匀的、带有刻度的细长玻璃管。下端有控制液体流量的玻璃活塞(或由橡皮管、玻璃球组
成的阀).
滴定管上有两种标志:一是标志液面高低的刻度线,其“0”刻度在上方,其他刻度线由小到大自上而下均匀分布,刻度线最小间隔为0.1mL,再大一点为1ml;最大刻度线在最下方;其二是标志滴定管的规格和使用温度的数值,如50mL 20℃或20mL20℃,且位于管的上方.
[注意] ①量筒无“0”刻度,其刻度从厂至上逐渐增大.
②量筒能准确读到0.1 ml.它只能粗略地计量液体的体积.
[说明] 查漏.滴定管在使用前,首先要检查其是否漏水,只有不漏水的滴定管才能使用.本实验主要练习酸式滴定管的使用方法,酸式滴定管是否漏水的检查方法是:
①将滴定管活塞关闭,向其中装水至“0”刻度线附近.用滴定管夹把滴定管固定在铁架台上.
②观察滴定管的尖嘴处和玻璃活塞处约1 min,看是否漏水.若所观察部位有一处或两处有水漏出,则不合格,要修理活塞或更换滴定管。若所观察部位两处均无水漏出,就将活塞旋转180°,再次按上述方法和要求观察,检查滴定管是否合格.若不合格,要修理活塞或更换滴定管;若合格,该滴定管可以使用.
5.注意掌握有关混合物的计算技能,如:差量法、守恒法、极端假设法等,不断总结解题方法和技巧,提高应用化学知识的能力.
4.注意知识的整理归纳,形成知识网络.
学习钠及其化合物的化学性质以后,应立即整理归纳,使之形成知识网络.
如:钠的知识可整理归纳如下:
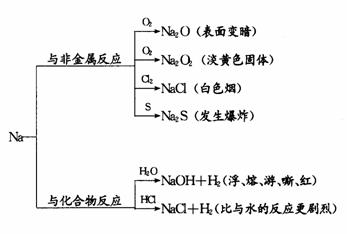
这样整理编织成网后,在头脑中进行有序储存,加深了理解,增强了记忆.
3.重视实验,从实验现象的观察、分析入手,得出结论.
化学是一门以实验为基础的科学,观察是认识活动的起点.学习时,要重视实验,或自己动手操作,或由老师演示.在学习过程中,对各种实验现象进行全面、细致的观察,并对观察的结果及时、如实地做好记录.因此上化学课时要集中注意力,会看、会听、会想.听老师讲,明确实验目的,以便重点观察,做到听与看相结合;把观察到的各种实验现象联系起来进行思考分析,做到看与想相,结合,养成良好的观察习惯,培养观察实验的能力和思维能力,观察实验要明确:
观察顺序:有目的、有顺序的观察,按从始至终、从上至下、从外至内的顺序观察;
观察内容:看颜色的变化、状态的变化、发光、着火、火焰的颜色、气泡或沉淀的产生及反应速率等.
如:钠跟水的反应,把一小块钠投入水中,可见钠浮在水面上,跟水剧烈反应,且立刻熔成一个银白色的小圆球(钠的密度小于水、熔点低于水的沸点),在水面上快速游动,并发出“嘶嘶”的响声,偶尔出现小火星,生成的气体移近火焰时,能产生轻微的爆鸣声,所得溶液可使酚酞试液变为红色,说明反应中生成了氢氧化钠和氢气:
2Na+2H2O=2NaOH+H2↑
钠与水的反应可以概括为“浮、熔、游、嘶、红”五个字来记忆.本实验中产生的现象多,观察时需认真仔细,不要漏掉任何一个实验现象.对实验的观察很重要,但对观察到的实验现象进行思考以得出结论则更重要,这是学习元素及其化舍物性质的重要方法之一.
2.归纳比较,讲究方法.
对一种具体的物质来说,其知识链的基本构成如下:
结构-性质-制法、用途、保存、鉴别、分离、除杂、提纯等,其关系为:
制法 鉴别
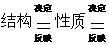 用途 分离除杂等
用途 分离除杂等
保存 提纯
我们要学会以物质的性质为中心,以物质的结构为基础的化学思维方法.物质为什么有这样的性质?要从物质的结构上找原因,物质为什么有这样的用途?它的保存、鉴别、分离等为什么能采用这样的方法?要从物质具有的物理性质和化学性质上去找根据,去理解问题,这是学习元素化合物知识的基本方法,也是形成化学思维的前提条件.
例如:学习钠在自然界中的存在和性质,要同钠的性质联系起来.钠是一种化学性质极活泼的金属,所以钠自然只能以化合态形式存在,而且主要是以钠盐的形式存在;通过钠跟氧气反应,就会联想到可用钠来制取过氧化钠;钠具有很强的还原性,联想到钠是一种强还原剂;此外,金属钠具有导电性、导热性,就可能联想到钠可用于原子反应堆和电光源上等.
总之,从物质的性质入手,推导出物质的存在和用途,这是掌握物质的存在和用途的最佳方法.根据这样的思路进行思考和学习,会起到事半功倍的效果.
1.抓住重点,以点带面.
锂、钠、钾、铷、铯、钫六种金属元素,原子的最外层都只有一个电子,结构相似,化学性质也相似,它们形成的氧化物溶于水后都生成强碱,故统称为碱金属.在碱金属中,钠最重要,性质最为典型,是学习的重点.在学习钠的基础上,再学习其他碱金属元素,掌握碱金属元素的重要性质和变化规律.其他碱金属的性质与钠十分相似,这是由它们原子结构的相似性(最外电子层都只有一个电子)所决定的.另一方面,它们的性质也存在着差异,而且其变化具有一定规律性.这是由于随着核电荷数的增大,电子层数增多,其原子半径增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子越来越容易,则它们的金属性逐渐增强.此外,它们单质的物理性质也呈现规律性的变化.学习本章元素时,可遵循以下思路或方法:典型解剖→类比推导→归纳总结(共性和个性)→提高学习效率.
3.本章重点:钠的化学性质和碱金属元素性质的比较.
本章难点:碱金属元素性质的比较.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com