
题目列表(包括答案和解析)
0.1 mol KOH的质量为:
m(KOH)=n(KOH)·M(KOH)=0.1 mol×56 g/mol=5.6 g.
答:配制500mL 0.2 mol/L KOH溶液,需要KOH的质量是5.6g.
再如:(已知H2S通常为气体,易溶于水)现有250 mL 0.800 mol/L H2S溶液, 求其中溶解的H2S在标准状况下的体积.
(分析) 本题的已知条件和计算要求与上题很相似,不同之处是溶液的溶质是H2S气体,需要求出H2S在标准状况下的体积.
解:250 mL 0.800 mol/L H2S溶液中H2S的物质的量为:
n(H2S)=c(H2S)·V[H2S(aq)]=0.800mol/L×0.250 L=0.200mol,
2.从1 L 1 mol/L C12 H22O11溶液中取出100 mL,取出的溶液中C12H22O11的物质的量浓度是多少?
点拨 仍为1 mol/L.溶液是均一、稳定的混合物,即全部的溶质在全部的溶剂中以分子或离子的微粒形态最大限度地分散,在溶液里的任意两处的溶质与溶剂的质量比、物质的量比等关系,都是完全相同的,也就是说,溶质在整个溶液里的浓度是均匀的.因此,从1 L 1 mol/L的C12 H22O11溶液中取出100 mL,取出的溶液中C12H22O11的物质的量浓度仍为1 mol/L.
例如:在一定温度下将300 mL 4 mol/L NaCl溶液分为200 mL(记为A)和100 mL(记为B)两份,判断下列说法是否正确,正确的在( )内打“√”,错误的在( )内打“×”.
(1)A和B中NaCl的物质的量浓度相同. ( )
(2)A中NaCl的物质的量浓度较大. ( )
(3)A中NaCl的物质的量较小. ( )
(4)B中NaCl的物质的量较小. ( )
(5)A和B的密度相同. ( )
(6)A中H2O的物质的量较大. ( )
(分析) A与B同是从300 mL 4 mol/LNaCl溶液中分离出来的不同体积的溶液,它们中NaCl的物质的量浓度、NaCl的质量分数、溶液密度等都相同,溶液体积、溶液质量、溶质(或溶剂)的质量、物质的量等都不同.
答案:(1)√ (2)× (3)× (4)√ (5)√ (6)√
又如:1 mol/L的NaCl溶液表示 ( )
A.溶液中含有1 molNaCl B.1 mol NaCl溶于1 L水中
C.58.5 g NaCl溶于941.5 g水中 D.1 L溶液中含有NaCl 58.5 g
(分析)1 mol/L的NaCl溶液,表示该NaCl溶液中溶质的物质的量浓度为 1 mol/L,即1 LNaCl溶液中含有1 molNaCl.
答案:D
再如:下列不是表示物质的量浓度的单位是 ( )
A.mol/m3 B.mol/cm3
C.g/mL D.mol/mL
答案:C
Ⅲ 物质的量浓度一定时溶液中溶质的微粒数目 ( )
如 2 L 0.5 mol/L 蔗糖
(1)溶质是非电解质时,溶质在溶液中以分子形式存在.如2 L 0.5 mol/L蔗糖溶液中,含有1 mol亦即NA个蔗糖分子.
(2)溶质是强电解质时[强酸如NaOH、KOH、Ba(OH)2、盐如NaCl、K2SO4等],溶质在溶液中以阴、阳离子的形式存在.如1L1 mol/L的CaCl2溶液中,含1 molCa2+、2 mol Cl-,亦即含有的Ca2+和Cl-分别为NA和2NA个.
(3)溶液中微粒浓度的关系.
如在n mol/L的Na2SO4溶液中
①离子浓度关系:c(SO2-4)=n mol/L,c(Na+)=2n mol/L.
则c(Na2SO4):c(SO2-4):(Na+)=1:1:2.
②电荷守恒关系:2c(SO2-4)=c(Na+),即电中性原则.溶液中阴离子所带负电荷总数与阳离子所带正电荷总数相等,溶液不显电性.如在Na2SO4、KCl的混合溶液中,2c(SO2-4)+c(Cl-)=c(Na+)+c(K+).
例如:NA表示阿伏加德罗常数,下列关于0.2mol/L的CaCl2溶液的说法中,不正确的是 ( )
A.2 L溶液中含有阴、阳离子的总数为0.8NA
B.500 mL溶液中Cl-的物质的量浓度为0.2 mol/L
C.500mL溶液中Ca2+的物质的量浓度为0.2 mol/L
D.500mL溶液中含Cl-的总数为0.2NA
(分析) 由CaCl2=Ca2++2Cl-可知:n(CaCl2)=n(Ca2+),n(Cl-)=2n(CaCl2),因此A项中n(CaCl2)=0.2 mol/L×2 L=0.4 mol,n(Ca2+)=0.4 mol,n(Cl-)=0.8 mol,n(总)=0.4 mol+0.8 mol=1.2 mol;B项中c(Cl-) =2×0.2mol/L=0.4mol/L;C项中c(Ca2+)为0.2 mol/L;D项中n(Cl-)=0.5 L×0.2 mol/L×2=0.2 mol.
答案:AB
知识点2 一定物质的量浓度溶液的配制(重点、难点)
Ⅰ配制原理:使一定物质的量的溶质溶解于溶剂中形成一定体积的溶液的实验操作.
Ⅱ配制关键:(1)准确测量溶质的量;(2)准确测量溶液的体积.
Ⅲ配制一定物质的量浓度溶液的主要仪器.
(1)准确测量溶质的量的主要仪器.
物质的物质的量是无法直接测量的,但物质的量与质量、物质的量与溶液体积之间存在着密切的、可以相互换算的关系.物质的质量和液体的体积都是比较容易测量出来的.因此,在配制一定物质的量浓度溶液时,准确测量溶质的量就转化为测量溶质的质量或体积了.
若溶质是固体,测其质量的主要仪器,严格地讲应该是精确度可达万分之一克的分析天平或电子天平,在目前的中学阶段是用精确度仅为十分之一克的托盘天平;若溶质为液体,测其体积的主要仪器是精确度可达到万分之一升的滴定管.
(2)准确测量所配制的溶液体积的主要仪器是一种容积精确的仪器--容量瓶.
容量瓶有各种不同的规格,常用的有100mL、250 mL、500 mL和1000 mL等几种(如图3-13所示).
[说明] 配制一定物质的量浓度的溶液,所用的主要仪器还有烧杯、玻璃棒、胶头滴管、量筒、药匙、试剂瓶等.
Ⅳ配制一定物质的量浓度溶液的方法和步骤.
(1)计算:求配制一定物质的量浓度的溶液所需溶质的质量或体积.
(2)称量:用托盘天平称量固体溶质,用量筒量取所需液体溶质或浓溶液.
(3)溶解或稀释:在烧杯中溶解或稀释,并且静置溶液使其恢复到室温,以免引起误差.
(4)转移:用玻璃棒引流,将溶液小心地转入一定体积的容量瓶中.
(5)洗涤:用蒸馏水洗涤烧杯2-3次,洗涤液也转入容量瓶中.
(6)定容:向容量瓶中加水至离刻度线2 cm-3 cm处,改用胶头滴管加水至刻度.
(7)摇匀:将容量瓶用瓶塞盖好,反复上下颠倒,摇匀.
Ⅴ配制一定物质的量浓度的溶液应注意的问题.
(1)配制一定物质的量浓度的溶液是将一定质量或体积的物质按所配溶液的体积在选定的容量瓶中定容,因而不需计算水的用量.
(2)因为用于定容的容量瓶的规格是固定的,因此不能配制任意体积的物质的量浓度的溶液.
(3)溶液注入容量瓶前需恢复到室温,这是因为溶质在烧杯内溶解或稀释时总有热效应的缘故.
(4)配制一定物质的量浓度溶液时,切不可直接将溶质放入容量瓶中,更不能将容量瓶用于化学反应,因为容量瓶属于容量仪器.
(5)配制NaOH溶液称取NaOH固体时,必须用称量瓶或用烧杯快速称量.因NaOH固体易潮解且有腐蚀性,称量过程中时间越长,吸水越多,导致所配溶液浓度偏低;若在纸上直接称量,NaOH吸水潮解,易沾在滤纸上损失,使所配溶液浓度偏低,另外,潮解后固体表面的溶液会渗过滤纸腐蚀托盘.
(6)量筒内壁的残液不要洗下倒入烧杯.因为量筒是一种“流出量”式量器,流出量筒的液体体积等于刻度所示体积.
(7)使用移液管移取液体时,应将移液管用蒸馏水洗涤,然后用液体润洗,否则将使所配溶液浓度偏低.另外,移液管尖嘴部分残留的液滴不能吹入烧杯中,否则会使所配溶液浓度偏高.
(8)溶质溶解并转移到容量瓶中后,必须用少量蒸馏水将烧杯内壁及玻璃棒洗涤2-3次,并将洗涤液倒入容量瓶中,因为烧杯内壁及玻璃棒表面沾有溶质,如不洗涤,将使所配溶液浓度偏低.
(9)定容时应使溶液的凹液面与刻度线相切,如果定容时俯视刻度线,实际加水量未达到刻度线,将使溶液体积减小,所配溶液浓度偏高;如果定容时仰视刻度线,实际加水量超过刻度线,将使溶液体积增大,所配溶液浓度偏低.
(10)如果加水定容时超过了刻度线,不能将超出部分吸走,必须重新配制,因为如果吸走一部分液体,虽然溶液的体积达到了要求,但吸走的那一部分液体带走了一些溶质,使所配溶液浓度偏低.
(11)如果摇匀时不小心洒出一些,不能再补加水到刻度,必须重新配制.因为洒出的溶液带走了一部分溶质,再补加水,同样也会使所配溶液浓度偏低.
(12)定容后摇匀溶液时,出现液面低于刻度线时不要加水,这是因为容量瓶属于“容纳量”式玻璃量器(指注入量器的液体体积等于刻度所示体积),用胶头滴管定容到液面正好和刻度线相切时,溶液的体积恰好为容量瓶的标定容量.之所以容量瓶振荡后会出现液面低于刻度线的情况,是因为有极少量的溶液残留在瓶塞磨口处,若再加水,将使所配制的溶液浓度偏低.
Ⅵ配制一定物质的量浓度溶液的误差分析
由物质的量浓度的数学表达式cB=可知,凡是使溶质的物质的量增大,或使溶液体积减小的操作,都将使所配溶液浓度偏高;反之,将使所配溶液浓度偏低.
以配制某浓度NaOH溶液为例列表分析如下:
|
引起误差的操作 |
nB |
V |
c |
|
称取时间过长或用滤纸称放 |
减小 |
- |
偏小 |
|
向容量瓶中注液时有少量液体流出 |
减小 |
- |
偏小 |
|
未洗净烧杯或玻璃棒 |
减小 |
- |
偏小 |
|
未冷却至室温而注入容量瓶中定容 |
- |
减小 |
偏大 |
|
定容时加水过量用滴管吸出 |
减小 |
- |
偏小 |
|
定容后俯视标线 |
- |
减小 |
偏大 |
|
定容后仰视标线 |
- |
增大 |
偏小 |
|
定容摇匀后液面下降又加水 |
- |
增大 |
偏小 |
|
定容摇匀后,液面下降 |
- |
- |
- |
例如:配制500mL 0.5 mol/L NaOH溶液,试回答下列问题.
(1)计算需要NaOH固体的质量为______.
(2)配制方法.设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线2cm-3 cm:
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④在烧杯中加入少量的蒸馏水,小心洗涤2-3次后移人容量瓶中;
⑤改用胶头滴管加蒸馏水至刻度线。加盖摇匀.
其正确顺序为_______.(填步骤序号)
(3)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是______.
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解NaOH后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
答案:(1)10.0 g
(2)①③④②⑤
(3)ACD
又如:实验室要配制含0.17 mol K2SO4,0.16 mol KCl,0.5 mol NaCl的混合溶液1 L.现因无K2SO4,只有Na2SO4、KCl、NaCl,如何配制所需溶液?简述操作步骤.
(分析) 无K2SO4只有用Na2SO4、KCl、NaCl代替.要多少Na2SO4、KCl、NaCl相互混合才能满足题中所述要求?首先要进行计算.
依题意,0.17 mol K2SO4和0.16mol KCl中的K+由KCl提供,根据K+的物质的量守恒,n(KCl)=n(K+)=0.17 mol×2+0.16 mol×1=0.50 mol,m(KCl)=0.50 mol× 74.5 g/mol=37.3 g.
根据SO2-4的物质的量守恒,n(Na2SO4)=n(K2SO4)=0.17 mol,故m(Na2SO4)=0.17 mol×142 g/mol=24.1 g.
根据Na+的物质的量守恒,n(NaCl)=0.5 mol-0.17 mol×2≈0.16 mol,所以, m(NaCl)=0.16 mol×58.5g/mol=9.4g.
答案:用天平称取37.3 gKCl,24.1 gNa2SO4,9.4 g NaCl放入一个烧杯中,加入适量蒸馏水,搅拌,使之全部溶解,转移到1 L容量瓶中,用蒸馏水洗涤烧杯、玻璃棒2-3次,把洗涤液都注入容量瓶里,然后缓缓地把蒸馏水注入容量瓶中,直到液面接近刻度线2 cm-3 cm处,改用胶头滴管加水至瓶颈刻度线处,使溶液的凹液面正好跟刻度线相切,塞好塞子,摇匀.把配好的溶液转入其他试剂瓶内保存.
[说明] 当没有所配的溶质时,可用其他试剂代替配制,配制时首先确定所配溶液里的离子的量,然后以此为标准推算需其他溶质的量.
知识点3 关于物质的量浓度的计算(重点)
在中学化学的现阶段要求能熟练地进行以下三种类型的计算:
Ⅰ关于物质的量浓度的计算
主要公式:
(1)中心公式:cB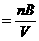
(2)相关联公式:n=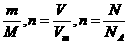 .
.
例如:将23.4gNaCl溶于水中,配成250 mL溶液。计算所得溶液中溶质的物质的量浓度.
(分析) 物质的量浓度就是单位体积溶液里所含溶质的物质的量.因此,本题可以根据物质的量浓度的概念以及溶质的质量、物质的量和摩尔质量的关系进行计算.
解:23.4gNaCl的物质的量为:
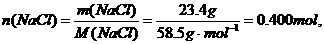
溶液中NaCl的物质的量浓度为:
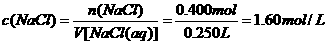 .
.
答:溶液中NaCl的物质的量浓度为1.60mol/L.
[注意]①数字运算要保留三位有效数字.
②在列算式时,一般要将各步算式以“=”号为准上下对齐.
③符号V[NaCl(aq)]为NaCl水溶液的体积,不能写成“V(NaCl)”,因为“V(NaCl)”表示的是NaCl的体积.
又如:配制500 mL 0.2 mol/L KOH溶液,需要KOH的质量是多少?
(分析) 可以根据题意先计算出500mL 0.2mol/L KOH溶液中溶质的物质的 量,然后再利用KOH的摩尔质量,计算出所需的KOH的质量.
解:500mL 0.2mol/L KOH溶液中KOH的物质的量为:
n(KOH)=c(KOH)·V[KOH(aq)]=0.2 mol/L×0.5 L=0.1 mol.
1.将342gC12H22O11(蔗糖)溶解在1 L水中,所得的溶液中溶质的物质的量浓度是否为1 mol/L?
点拨 不是1 mol/L.因为将342 g蔗糖溶解在1L水中,所得溶液的体积不是1 L,应大于1 L,而342 g蔗糖的物质的量为1 mol,故所得溶液中溶质的物质的量浓度小于1 mol/L.
4.初步学会配制一定物质的量浓度溶液的方法和技能.
本节重点:物质的量浓度的概念及其有关的计算;一定物质的量浓度的溶液的配制方法.
本节难点:正确配制一定物质的量浓度的溶液.
教材解读 精华要义
相关链接
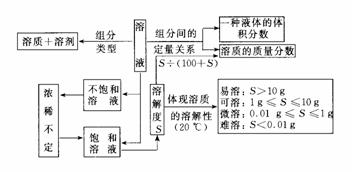
有关溶液的知识网络(初中化学部分)
知识详解
知识点1 物质的量浓度
Ⅰ理解物质的量浓度的准备
例如:完成下列填空:
(1)已知在0.5 LNaCl溶液中含有0.3mol NaCl,则在1 L NaCl溶液中含NaCl _____mol.
(2)已知在3 L NaOH溶液中含有6 mol NaOH,则在1 L NaOH溶液中含 NaOH_____mol.
(3)已知在5 L H2SO4溶液中含有10 mol H2SO4,则在1 L H2SO4溶液中含 H2SO4_____mol.
答案:(1)0.6 (2)2 (3)2
思维拓展 上述三种不同的溶液作出的计算结果,对于表达溶液的体积与溶质的物质的量间的关系有哪些共同点?
点拨 都表达了1L溶液里所含溶质的物质的量,或者说都表达了单位体积的溶液里所含溶质的物质的量.
Ⅱ物质的量浓度的概念(重点)
(1)文字表达法
以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理理,叫做溶质B的物质的量浓度(B表示各种溶质).
(2)数学表达式
物质的量浓度(cB)=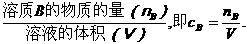
溶质的物质的量的单位通常是mol,溶液体积的单位通常是L或m3,那么物质的量浓度的常用单位就是mol/L或mol/m3.
[说明] ①物质的量浓度是溶液中溶质的物质的量与溶液的体积之比,即是用单位体积溶液中溶质的物质的量来表示溶液组成的一个物理量;从物质的量浓度的概念和数学表达式中,我们可以看出:物质的量浓度是用“ ”表示溶液的组成的,它与以“
”表示溶液的组成的,它与以“ ”为特征的溶质的质量分数有着本质的区别,但同时也有联系,可以相互换算,下表中对溶液中溶质的质量分数和物质的量浓度作了比较.
”为特征的溶质的质量分数有着本质的区别,但同时也有联系,可以相互换算,下表中对溶液中溶质的质量分数和物质的量浓度作了比较.
溶液中溶质的物质的量浓度和质量分数的比较
|
|
物质的量浓度(cB) |
溶质的质量分数(w%) |
|
溶液的单位 |
L |
g |
|
溶质的单位 |
mol |
g |
|
s计算公式 |
CB=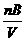 |
W(B)%= 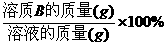 |
|
特点 |
物质的量浓度相同、溶液体积也相同的不同溶液里,含有溶质的物质的量相同 |
质量相同、质量分数也相同的不同溶液里,含有溶质的质量也相同 |
|
联系 |
物质的量浓度(CB)=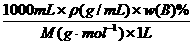 |
②由物质的量浓度的概念和公式可知,如果在1 L溶液中含有溶质B的物质的量为n mol.则这种溶液里B的物质的量浓度就是n mol/L.如1 L溶液里含有3 mol KNO3,该溶液中KNO3的物质的量浓度为3 mol/L.
③“B”在这里表示任意的溶质.B的组成可以是分子,如C12H22O11(蔗糖);也可以是离子,如Na+、Cl-;还可以是由阴、阳离子组成的结构单元,如:KNO3,分析溶质时要注意有关的化学变化,某些物质溶于水后,与水反应生成另一种物质,此时的溶质不是原物质,而是反应后生成的新物质.例如,Na、Na2O等物质加入到水中,溶质不是Na、Na2O,而是NaOH,nB则是n(NaOH);带结晶水的物质如 Na2CO3·10H2O、CuSO4·5H2O加入到水中,溶液中的溶质则是Na2CO3、CuSO4,而不是结晶水合物.这些情况是比较多见的,一定要根据加入的物质的不同情况,准确地求出溶质的量,但是像NH3、Cl2等物质溶于水后成分复杂,求算浓度时,仍以溶解前的NH3、Cl2为溶质.
④溶质的量无论是以什么单位给出的,都要转换成物质的量表示,溶液体积单位一般采用升;另外,溶液的体积混合前后是有变化的,即混合后溶液体积不等于混合前两种溶液体积的加和,也不等于混合前溶剂的体积,但有时研究问题可忽略这种变化,此时可根据混合前两种溶液体积的加和式,用混合前溶剂的体积来代表混合后溶液的体积,如果不能忽略这种变化,则要依据V=的关系来计算.
⑤mol/L与mol/m3的关系是1 mol/L=1000 mol/m3,或1×10-3mol/L=1 mol/m3.
[注意] 在cB=中,V是溶液的体积,不是溶剂的体积.
思维拓展
3.掌握一定物质的量浓度溶液加水稀释的计算.
2.掌握关于物质的量浓度的计算.
1.理解物质的量浓度的概念.
3.为什么滴定管要先用试剂润洗2-3次,而容量瓶却不能先用试剂润洗?
点拨 如果滴定管不用试剂润洗而其中又有少量蒸馏水,当加入试剂后,会使试剂的浓度变小.容量瓶若用试剂润洗,会在容量瓶中存有少量试剂,使所配制的溶液的浓度变大.
2.在使用容量瓶配制溶液时,为什么必须要待溶液的温度恢复到室温后再将溶液转移到容量瓶中?
点拨 因为玻璃的膨胀系数会随温度的改变而发生变化,容量瓶是玻璃制品,因此在容量瓶上一般标有使用温度.如果待配制的溶液的温度过高或过低.都会影响所配制溶液浓度的准确性.
1.在读取滴定管内液体的体积数时,俯视、仰视和平视得到的数据有什么差异? 这种差异与读取量筒内液体体积数时的差异有什么差别?
点拨 在读取滴定管的读数时,如果眼睛的位置偏高、偏低或滴定管放置歪斜,所读取的读数会有较大的误差.如仰视时得到的数据比平视偏大,俯视时得到的数据比平视的会偏小.
在实验室中,一般量筒没有“0”刻度,而滴定管的“0”刻度在上部,量筒刻度从下向上依次增大,而滴定管刻度从上到下依次增大,恰好相反.因此,从仰视与俯视得到的结果看,读数的大小也刚好相反.例如,在仰视时,对于滴定管,得到的数据会偏大,而对于量筒,得到的数据则会偏小;在俯视时,对于滴定管,得到的数据会偏小,而对于量筒,得到的数据则会偏大.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com