
题目列表(包括答案和解析)
3.以物质的量为中心的物理量关系

2.溶液稀释定律
c1V1=c2V2或m1·w1%=m2·w2%
1.溶液中溶质的物质的量、物质的量浓度、质量分数以及溶液的体积、密度之间的关系

注意各量的单位:c、n、V、ρ的单位分别是mol/L、mol、L、g/cm3.


溶液的物质的量浓度c(mol/L)
0.1 mol.生成的CO2和O2通入另一份Na2O2与NaHCO3的混合物中,只发生反应:2CO2+2Na2O2=2Na2CO3+O2,反应后气体的物质的量变为
 =0.09mol,导致此变化有两种可能:
=0.09mol,导致此变化有两种可能:
(1)Na2O2过量,最后剩余气体全部为O2,则:
2CO2 - O2 △V
2 1
x (0.1-0.09)mol
得x=0.02 mol,故原0.1 mol混合气体中含n(O2)=0.08 mol,所以每一份混合物中含n(NaHCO3)=n(CO2)=0.02
mol,含n(Na2O2)=0.08 mol×2=0.16 mol,得n(Na2O2):n(NaHCO3)=0.16 mol:0.02 mol=8:1,则此时 c(HCl)=  =3.4mol/L.
=3.4mol/L.
(2)若Na2O2不足,则产生的气体为CO2与O2的混合物,则:
2Na2O2-2CO2-O2 △V
2 1
y (0.1-0.09)mol
y=0.02 mol.
此时每一份混合物中含n(Na2O2)=0.02mol,生成m(O2)=  ×0.02mol=0.01 mol,故产生CO2为0.1 mol-0.01 mol=0.09 mol,故含n(NaHCO3)=0.09 mol,所以n(Na2O2):n(NaHCO3)=0.02:0.09=2:9,此时c(HCl)=
×0.02mol=0.01 mol,故产生CO2为0.1 mol-0.01 mol=0.09 mol,故含n(NaHCO3)=0.09 mol,所以n(Na2O2):n(NaHCO3)=0.02:0.09=2:9,此时c(HCl)=  =1.3mol/L.
=1.3mol/L.
答:略.
2.将Na2O2和NaHCO3的混合物分成等质量的两份,其中一份加100 mL稀盐酸,使其充分反应,溶液呈中性,放出气体2.24 L,将气体通入另一份混合物中充分反应后,气体体积变为2.016 L.求原混合物中Na2O2和NaHCO3的物质的量之比及盐酸溶液的物质的量浓度.(气体体积均在标准状况下测定)
答案:解:发生的反应为:2Na2O2+4HCl=4NaCl+O2↑+2H2O,NaHCO3+HCl=NaCl+H2O+CO2↑,产生O2和CO2的物质的量为 =
=
1.通常状况下,CO和O2的混合气体mL用电火花引燃后体积变为n L(反应前后条件相同).
(1)试确定混合气体中CO和O2的体积[用V(CO)和V(O2)表示];
(2)在相同条件下,若反应后气体的密度为H2密度的15倍,试确定反应后混合气体的成分.
答案:解:(1)由反应的化学方程式:2CO+O2 2CO2可知,反应前后气体体积的变化量等于消耗的O2量,所以消耗的V(O2)=(m-n)L,消耗的V(CO) 2= (m-n)L,因为m,n不确定,故分别讨论:
2CO2可知,反应前后气体体积的变化量等于消耗的O2量,所以消耗的V(O2)=(m-n)L,消耗的V(CO) 2= (m-n)L,因为m,n不确定,故分别讨论:
若O2不足,则V(O2)=(m-n)L,V(CO)=m L-(m-n)L=n L;
若O2过量,则V(CO)=2(m-n)L,V(O2)=m L-2(m-n)L=(2n-m)L.
(2)由阿伏加德罗定律的推论可知 =15×2=30,所以反应后的混合气体中一定有一种气体的式量小于30,故混合气体为CO2和CO.
=15×2=30,所以反应后的混合气体中一定有一种气体的式量小于30,故混合气体为CO2和CO.
答:略.
3.在标准状况下,一个装满Cl2的容器质量为74.6 g,若装满N2,则质量为66 g,则此容器的容积为______.
答案:4.48L[提示:因为n=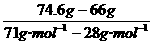 =0.2mol,V=0.2 mol× 22.4 L/mol=4.48 L]
=0.2mol,V=0.2 mol× 22.4 L/mol=4.48 L]
2.用20gNaOH配成250mL溶液,它的物质的量浓度为_______.取5mL该溶液,其物质的量浓度为________.再加水稀释到100 mL,则稀释后溶液中溶质的物质的量浓度为_______,其中含NaOH的质量为______.该100 mL溶液可以跟H+浓度为0.1 mol/L的硫酸溶液_____mL完全中和,生成正盐.
答案:2 mol/L;2 mol/L;0.1 mol/L;0.4 g;100
1.用固体NaOH配制一定物质的量浓度的溶液时,两次用到小烧杯,其作用分别是______和_____;两次用到玻璃棒,其作用分别是_____和______.若在滤纸上称量后进行溶解及以后操作,则所配溶液浓度 (填“偏高” “偏低”或“无影响”,下同);溶解后迅速转入容量瓶后进行以后操作,则所配溶液浓度______;NaOH在空气中放置时间过长,则所配溶液浓度______.
答案:称量;溶解;搅拌加快溶解;引流;偏低;偏高;偏低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com