
题目列表(包括答案和解析)
9.质量分数不同的两种硝酸溶液等质量混合时,其质量分数为a%;而等体积混合时,其质量分数为b%;质量分数不同的两种乙醇溶液等质量混合时,其质量分数为a%;而等体积混合时,其质量分数为c%,则a,b,c之间的大小关系为 ( )
A.a>b>c B.b>a>c
C.c>a>b D.无法确定
答案:B[提示:因HNO3浓度大时,密度大,故等质量混合时其质量分数为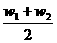 ,而等体积混合时其质量分数大于
,而等体积混合时其质量分数大于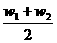 ,故b>a;而乙醇溶液浓度大时,密度小,故等质量混合时其质量分数为
,故b>a;而乙醇溶液浓度大时,密度小,故等质量混合时其质量分数为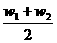 ,而等体积混合时w<
,而等体积混合时w<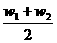 ,故a>c]
,故a>c]
8.将5g某金属加入100 mL 4mol/L的H2SO4溶液中,当H2SO4的浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解,该金属可能是 ( )
A.Al B.Zn
C.Fe D.Mg
答案:AD[提示:因H2SO4消耗一半,即 ×4 mol/L×0.1
L=0.2 mol时,金属还未全部溶解,则被溶解的金属质量一定小于5 g,由金属与酸反应的化学方程式可推出A、D两项正确]
×4 mol/L×0.1
L=0.2 mol时,金属还未全部溶解,则被溶解的金属质量一定小于5 g,由金属与酸反应的化学方程式可推出A、D两项正确]
7.已知某溶液的:①体积;②密度;③溶质和溶剂的质量比;④溶质的摩尔质量.要根据溶质的溶解度计算其饱和溶液中溶质的物质的量浓度时,上述条件中必不可少的是 ( )
A.①②③④ B.①②③
C.②④ D.①④
答案:C[提示:由饱和溶液的溶解度与物质的量浓度的换算关系直接推知]
6.配制一定物质的量浓度的溶液时,下列情况中能导致实验结果偏低的是 ( )
A.容量瓶中原有少量蒸馏水
B.溶解所用的烧杯用之前未洗涤
C.定容时俯视观察液面和刻度线
D.移液时,不慎将液体滴到瓶外
答案:D[提示:液体流到瓶外损失了溶质,导致所配溶液浓度偏低.A项无影响,C项偏高,B项不确定]
5.用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位是mol/kg,5mol/kg的H2SO4溶液的密度是1.2894 g/cm,则其物质的量浓度为 ( )
A.3.56 mol/L B.5.23mol/L
C.4.33 mol/L D.5.00 mol/L
答案:C[提示:由信息及物质的量浓度的定义知:5 mol/kg H2SO4的物质的量浓度为:
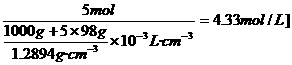
4.将密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止,已知所生成的溶液的质量等于原BaCl2溶液的质量,则硫酸溶液中H2SO4的物质的量浓度为 ( )
A.21.9% B.42.1%
C.13.5 mol/L D.5.67 mol/L
答案:D[提示:因H2SO4+BaCl2=BaSO4↓+2HCl恰好完全反应,故n(H2SO4)=n(BaSO4),由质量守恒有m(H2SO4溶液)=m(BaSO4).若n(H2SO4)=1 mol,则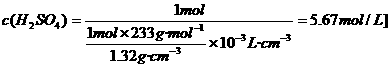
3.将质量分数分别为5x%的A溶液与x%的A溶液等体积混合后,其溶液中溶质的质量分数小于3x%,则A可能是下列物质中的 ( )
A.H2SO4 B.NaOH
C.C2H2OH D.NH3
答案:CD[提示:设体积为V mL,5x%的A溶液的密度为d1,x%的A溶液的密度为d2,则由质量分数定义可知,混合后溶液中溶质的质量分数为:
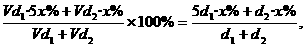
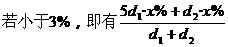 <3x%,解得d1<d2. 即浓度大时密度反而小的物质符合题意]
<3x%,解得d1<d2. 即浓度大时密度反而小的物质符合题意]
2.在无土栽培时,需要浓度为0.5 mol/L NH4Cl,0.16 mol/L KCl,0.24 mol/LK2SO4的营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体来配制1 L营养液,需此三种固体的物质的量分别为 ( )
A.0.4 mol,0.5 mol,0.12 mol
B.0.66 mol,0.5 mol,0.24 mol
C.0.64 mol,0.02 mol,0.24 mol
D.0.64 mol,0.5 mol,0.24 mol
答案:C[提示:设需KCl、NH4Cl、(NH4)2SO4三种物质的物质的量分别为x,y,z,由离子守恒得
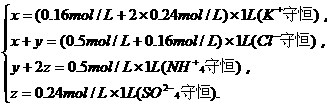
解得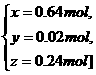
1.甲、乙、丙三种不同浓度的稀H2SO4分别跟等物质的量的Al、KHCO3和K2CO3刚好完全反应,消耗甲、乙、丙三种酸液的体积比为1:2:3,则甲、乙、丙三种酸中H2SO4溶液的物质的量浓度之比为 ( )
A.1:1:1 B.3:1:2
C.6:2:3 D.18:3:4
答案:D[提示:由化学方程式知,Al、KHCO3、K2CO3分别为1 mol时,分别消耗H2SO4
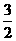 mol,
mol, mol,1 mol.由体积关系可知浓度之比为
mol,1 mol.由体积关系可知浓度之比为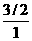 :
: :
: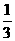 =18:3:4]
=18:3:4]
4.一定物质的量浓度溶液的配制
(1)主要原理: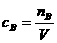
(2)仪器
(3)步骤
(4)误差分析
随堂练习 知识巩固
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com