
题目列表(包括答案和解析)
6.5 gCH4(甲烷)在足量O2中完全燃烧,生成CO2和H2O(气),将燃烧产物通过足量Na2O2后,Na2O2增加的质量是 ( )
A.5 g B.7 g
C.10g D.无法计算
答案:C[提示:CH4 + 2O2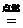 CO2 + 2H2O
CO2 + 2H2O
16 44 36
5 g 13.75g 11.25 g
2CO2+2Na2O2=2NaCO3+O2 △m
88 32 56
5.加热NaHCO3并趁热将生成的气体:①先通过Na2O2,增重a1 g,再通过浓H2SO4,增重b1 g;②先通过浓H2SO4,增重b2 g,再通过Na2O2,增重a2 g.则a1, a2,b1,b2从大到小的排列顺序是 ( )
A.a1>a2>b2>b1 B.b1>b2>a1>a2
C b2>b1>a2>a1 D.a2>a1>b2>b1
答案:A[提示:2NaHCO3=Na2CO3+H2O+CO2↑
168 18 44
2Na2O2+2CO2=2Na2CO3+O2 Δm
88 32 56
44 28
2Na2O2+2H2O=4NaOH+O2↑ Δm
36 32 4
18 2
a1=28+2=30,b1=0
若先通过浓H2SO4,则b2=18(H2O全部被浓H2SO4吸收),再通过Na2O2时,则a2=28,故大小顺序为a1>a2>b2>b1,答案为A]
4.将一定质量的金属钠在空气中燃烧,并将固体产物跟338 g水反应,收集到16 g气体,下列说法中,正确的是 ( )
A.原金属钠的质量是11.5g
B.原金属钠的质量是46g
C.所得溶液中溶质的质量分数为20%
D.所得溶液中溶质的质量分数为21.1%
答案:BC[提示:发生的反应有:2Na+O2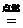 Na2O2 ①
Na2O2 ①
46 78
2Na2O2+2H2O=4NaOH+O2↑ ②
156 160 32
78 g 80 g 16 g
3.将Na2O2和过量的NaHCO3混合,在密闭容器中加热后,最后排出气体物质,则所得残留物是 ( )
A.Na2O和Na2O2 B.Na2O2和Na2CO
C.Na2CO3 D.Na2O
答案: C[提示:由于NaHCO3过量,分解产生的CO2、水部分被Na2O2吸收生成Na2CO3,余者排出,故最后容器内残留的物质只有Na2CO3]
2.下列有关过氧化钠与水反应的说法正确的是 ( )
A.转移电子数为4
B.水是氧化剂
C.过氧化钠既是氧化剂又是还原剂
D.过氧化钠只是氧化剂
答案:C
酸式盐与碱反应的离子方程式的写法
NaHCO3与二元碱[如Ca(OH)2、Ba(OH)2]反应时的离子方程式的写法通常有多种形式,其原因是两者相互间反应的量的关系所导致.
(1)当NaHCO3与Ca(OH)2按物质的量之比为1:1反应时,即NaHCO3不充足时,化学方程式和离子方程式为:
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
HCO-3+Ca2++OH-=CaCO3↓+H2O
(2)当NaHCO3与Ca(OH)2的物质的量之比为2:1时,即NaHCO3足量时,化学方程式和离子方程式为:
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
2HCO-3+Ca2++2OH-=CaCO3↓+CO2-3+2H2O
同理Ca(HCO3)2与NaOH反应时也存在上述现象:
NaOH不足时,
Ca2++HCO-3+OH-=CaCO3↓+H2O
NaOH充足时,
Ca2++2HCO-3+2OH-=CaCO3↓+CO2-3+2H2O
规律:酸式盐与碱反应时,不足量物质的离子数之比等于化学式之比.
但Ca(HCO3)2和二元碱Ca(OH)2或Ba(OH)2反应只有一种情况:
Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O
Ca2++HCO-3+OH-=CaCO3↓+H2O
随堂练习 知识巩固
1.下列除杂质试剂的选择中.不正确的是 ()
A.KHCO3中混有K2CO3(CO2)
B.NaOH中混有Na2O2(H2O)
C.Na2CO3中混有NaHCO3(CaCl2)
D.KNO3中混有KHCO3(HNO3)
答案:C[提示:A中发生反应:K2CO3+CO2+H2O=2KHCO3;B中发生反应: 2Na2O2+2H2O=4NaOH+O2↑;C中发生反应:Na2CO3+CaCl2=
CaCO3↓+2NaCl;D中发生反应:KHCO3+HNO3=KNO3+H2O+CO2↑.只有C不但没将杂质除去反而消耗了原物质,故答案为C]
钠的化合物
9.在某温度下,一定量的元素A的气态氢化物AH3,在一定容积的密闭容器中可以完全分解成两种气态单质,此时压强增加了75%,则A单质的一个分子中有 ______个A原子,AH3分解反应的化学方程式是_____.
答案: 4;4AH3=A4+6H2[提示:已知AH3分解成两种气态单质,在密闭容器内压强增加了75%,从阿伏加德罗定律的推论中可知,同温同体积的条件下: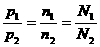 ,因此压强增加了75%就意味着密闭容器中气体分子数增加了75%.设AH3分解的化学方程式为
,因此压强增加了75%就意味着密闭容器中气体分子数增加了75%.设AH3分解的化学方程式为
xAH3=Ax+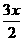 H2,反应前是x个分子,反应后是1+
H2,反应前是x个分子,反应后是1+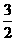 x个分子,根据题意有
x个分子,根据题意有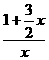 =1+75%,解得 x=4]
=1+75%,解得 x=4]
8.同温、同压下,由CO2、H2和CO组成的混合气体的密度与N2的密度相同,则该混合气体中CO2、H2和CO的体积比为 ( )
A.28:8:13 B.22:1:14
C.13:8:29 D.26:16:57
答案:CD[提示:由于CO与N2具有相同的相对分子质量,所以CO2、H2、CO混合气体的平均相对分子质量仅由CO2和H2来决定,CO的量可认为是任意值,由十字交叉法: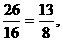 C、D两项符合]
C、D两项符合]
7.常温下,在密闭容器中分别充入两种气体各0.1 mol,一定条件下充分反应,恢复 到原温度时,压强降低为开始时的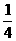 ,则原混合气体可能是 ( )
,则原混合气体可能是 ( )
A.H2和O2 B.HCl和NH3
C.H2和Cl2 D.CO和O2
答案:A[提示:A项中,等物质的量的H2和O2反应,剩余0.05 mol O2,压强变为原来的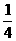 ;B中,HCl和NH3恰好完全反应生成固体NH4Cl,压强为0;C中,H2和Cl2
反应后物质的量不变,压强不变;D中,CO与O2反应生成气态的CO2,压强变为原来的
;B中,HCl和NH3恰好完全反应生成固体NH4Cl,压强为0;C中,H2和Cl2
反应后物质的量不变,压强不变;D中,CO与O2反应生成气态的CO2,压强变为原来的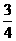 ]
]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com