
题目列表(包括答案和解析)
4.下列各组实验中,反应最快的是 ( )
|
组号 |
温度 |
Na2S2O3 |
H2SO4 |
H2O 体积 |
||
|
体积 |
浓度 |
体积 |
浓度 |
|||
|
A |
0℃ |
10mL |
0.1mol·L-1 |
10mL |
0.1mol·L-1 |
0 |
|
B |
10℃ |
5 mL |
0.1mol·L-1 |
5 mL |
0.1mol·L-1 |
10mL |
|
C |
30℃ |
5 mL |
0.1mol·L-1 |
5 mL |
0.1mol·L-1 |
10mL |
|
D |
30℃ |
5 mL |
0.2mol·L-1 |
5 mL |
0.2mol·L-1 |
10mL |
3.SO2和O2是在催化剂表面上接触时发生反应的,所以这种生产硫酸的方法叫接触法,接触法制硫酸的工艺中SO2的转化率为90%,已知在101 kPa 时每l mol SO2被氧化成l mol SO3放出热量98.3 kJ,则下列热化学方程式正确的是 ( )
A.SO2(g)+ O2(g) === SO3(g);△H=-98.3
kJ·mol-1
O2(g) === SO3(g);△H=-98.3
kJ·mol-1
B.2SO2(g)+O2(g)=== 2SO3(g);△H=-176.94 kJ·mol-1
C.SO2(g)+ O2(g)==== SO3(g);△H=-88.47
kJ·mol-1
O2(g)==== SO3(g);△H=-88.47
kJ·mol-1
D.2SO2(g)+O2(g)== 2SO3(g);△H=+196.6 kJ·mol-1
2.下列对化学反应的认识错误的是 ( )
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
1.下列各图中表示正反应是吸热反应的图是 ( )

2.关于Na2CO3和NaHCO3的检验和除去方法.
点拨 (1)检验Na2CO3固体中混有的NaHCO3--方法是加热,产生的气体通入澄清石灰水中变浑浊,则含NaHCO3.
(2)检验NaHCO3溶液中混有的Na2CO3-一方法是加入CaCl2(BaCl2)溶液,产生白色沉淀,则含有Na2CO3.
(3)除去Na2CO3固体中混有的NaHCO3--方法是加热至不产生气体为止.
(4)除去NaHCO3液中混有的Na2CO3--方法是通入过量CO2气体.
1.联合制碱法制纯碱的原理是什么?(原料是NaCl、CO2、NH3)
点拨 在饱和食盐水中使NH3达到饱和后,再通入CO2:
NH3+CO2+H2O=NH4HCO3
生成的NH4HCO3溶解度大,而NaHCO3的溶解度小,故产生沉淀:
NaCl+NH4HCO3=NaHCO3↓+NH4Cl
(总方程式:NaCl+NH3+CO2+H2O=NaHCO3↓++NH4Cl)
将析出的沉淀加热,制得Na2CO3(纯碱).
3.在NaHCO3加热分解的实验完成时,为什么要先将导管移出烧杯,然后再熄灭酒精灯?
点拨 在完成实验时,如果先熄灭酒精灯。再移走装有石灰水的烧杯,会使烧杯内的冷水倒流回试管,而使试管炸裂.
小结 碳酸钠和碳酸氢钠的比较如下表:
|
名称 |
碳酸钠 |
碳酸氢钠 |
|
|
俗名 |
纯碱、苏打 |
小苏打 |
|
|
物理性质 |
色态 |
白色粉末 |
细小白色晶体 |
|
稳定性 |
稳定,但Na2CO3·10H2O易风化 |
受热易分解 |
|
|
水溶性 |
易溶于水 |
易溶于水 |
|
|
化学性质 |
与酸反应 |
H++CO2-3=HCO-3 H++HCO-3=CO2↑+H2O |
HCO-3+H+=CO2↑+H2O |
|
与碱反应 |
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
HCO-3+OH-=CO2-3+H2O Ca2++OH-+HCO-3=CaCO3↓+H2O(碱过量) Ca2++2OH-+2HCO-3=CaCO3↓+CO2-3+2H2O(碱不足) |
|
|
与CaCl2反应 |
Ca2++CO2-3=CaCO3↓ |
不反应 |
|
|
用途 |
制玻璃、造纸、制皂、洗涤剂 |
发酵粉、灭火剂、治疗胃酸过多 |
|
|
鉴别 |
①加热 |
不分解 |
分解产生能使澄清石灰水变浑浊的气体 |
|
②加酸 |
放出气体慢 |
放出气体快 |
|
|
③与酸反滴 |
现象与滴加顺序有关 |
现象与滴加顺序无关 |
|
|
④加盐 |
加CaCl2产生白色沉淀 |
加CaCl2无明显现象 |
|
|
|
|
||
|
相互转化 |
CO2+H2O Na2CO3 ===================NaHCO3 ①固加热②液加NaOH |
[注意] ①热稳定性:Na2CO3>NaHCO3>H2CO3.
②电离方程式:Na2CO3=2Na++CO2-3
NaHCO3=Na++HCO-3
思维拓展
2.怎样鉴别NaHCO3溶液与Na2CO3溶液?
点拨 方法1:向两种溶液中分别加入CaCl2溶液.NaHCO3不与CaCl2反应, 而Na2CO3与CaCl2反应生成CaCO3沉淀.
方法2:向两种溶液中滴加稀HCl.Na2CO3溶液中滴加稀HCl,只有少量气体生成,甚至无气体放出.NaHCO3溶液中滴加稀HCl,则立即有气体(大量)放出.
1.将稀盐酸缓慢滴入Na2CO3溶液及NaHCO3溶液中,现象有何差别?
点拨 向Na2CO3溶液中滴入稀盐酸,理论上并无CO2气体生成,因为Na2CO3先与稀盐酸反应生成NaHCO3:Na2CO3+HCl=NaHCO3+NaCl,当溶液中的Na2CO3完全转变成NaHCO3之后,再滴入HCl,才产生CO2气体(实际上,由于局部的HCl过量,会有少量气体生成).往NaHCO3中滴入HCl,则立即有大量气体生成.
2.氢氧化钠的性质和用途
氢氧化钠是一种重要的碱,是一种白色固体,极易溶于水,溶解时放出大量的热,其水溶液是无色透明的液体.氢氧化钠固体在空气中容易吸收水分而潮解.“容易吸收水分”这一点,决定了氢氧化钠固体可以作干燥剂(用来干燥中性气体或碱性气体),如干燥氢气、氧气等,但是不能用来干燥二氧化碳气体,因为氢氧化钠能跟二氧化碳发生化学反应.同时氢氧化钠也可用作CO2和H2O(g)的吸收剂,NaOH与生石灰按照一定比例混合可制成碱石灰,作为CO2和H2O(g)的吸收剂.另外NaOH还具有强烈的腐蚀性.
氢氧化钠俗称烧碱、火碱.它具有碱的通性,碱性很强,腐蚀性强.它很容易和大多数非金属氧化物及多种酸发生反应,生成盐和水;也很容易和许多盐溶液发生反应,生成难溶性的碱.所以化学上常用氢氧化钠制取难溶性碱,如氢氧化镁、氢氧化铜、氢氧化铁等.
由于NaOH能与玻璃成分中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3为矿物胶,所以盛NaOH的试剂瓶不能用玻璃塞,应用橡胶塞,否则玻璃塞与瓶口容易黏结.另外需注意的是为了避免NaOH吸收空气中的CO2和H2O,NaOH必须密封保存.
氢氧化钠主要应用于工业中.例如,我国四大发明之一的造纸,在其生产过程中氢氧化钠就起到溶解造纸原料--木材或草类植物里的非纤维素成分的作用,从而得到以纤维素为主要成分的纸浆.在纺织印染工业中,一般先将棉织品在适当温度下放于稀氢氧化钠溶液中浸泡蒸煮,除掉棉织品表面的覆盖物,才能使染色均匀、牢固.在以上两例中都是利用了氢氧化钠的腐蚀性,可见腐蚀性有其破坏性的一面,也有可利用的一面.在精炼石油的过程中,主要是利用氢氧化钠与酸发生中和反应的性质,除去精炼过程中剩余的硫酸和其他酸性物质.
知识详解
知识点1 钠的氧化物(重点)
Ⅰ过氧化钠与水的反应
 实验2-4:过氧化钠与水的反应实验
实验2-4:过氧化钠与水的反应实验
实验目的:认识过氧化钠的不稳定性和氧化性.
实验原理:过氧化钠与水反应,放出氧气,同时生成氢氧化钠.
实验用品:过氧化钠、酚酞、试管、滴管、木条、火柴、酒精灯.
实验步骤:把水滴入盛有Na2O2固体的试管中,用带火星的木条放在试管口,检验生成的气体(如图2-10所示).向放出氧气后的试管中加入少量的水,再滴入2滴酚酞试液,观察现象.
实验现象:带火星的木条剧烈燃烧起来;试管内的溶液由五色变为红色.
实验分析:带火星的木条剧烈燃烧起来,说明实验中有助燃剂生成.酚酞试液显红色,说明实验中有碱生成.试管中的反应物是Na2O2和H2O,对反应物的组成和实验现象进行综合分析可知,使带火星的木条剧烈燃烧的是O2,使酚酞试液显红色的是NaOH.
实验结论:在通常状况下,Na2O2与H2O剧烈反应,生成NaOH和O2:
2Na2O2+2H2O=4NaOH+O2↑
[注意] ①过氧化钠在保存过程中易变质,若实验中产生的氧气较少,一般为过氧化钠变质所致.解决这个问题的办法是拨去试剂瓶中过氧化钠的表面部分,另取未变质的过氧化钠,或者是更换一些保存完好的过氧化钠.
②取出过氧化钠以后,要及时、快速地将试剂瓶盖严.
③实验所用的试管,内壁要干燥,防止过氧化钠过早地与水反应.
④在向试管内滴加酚酞试液之前,要先向试管内加入足量的水,其目的一是使过氧化钠充分反应;二是使溶液降温.否则,酚酞试液会显示异常现象.
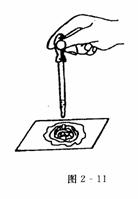 实验2-5:过氧化钠使棉花燃烧的实验
实验2-5:过氧化钠使棉花燃烧的实验
实验目的:认识过氧化钠的不稳定性和氧化性.
实验原理:过氧化钠与水反应,放出氧气,同时生成氢氧化钠.
实验用品:过氧化钠、水、石棉网、滴管、木条、棉花.
实验步骤:用棉花包住约0.2 g Na2O3粉末,放在石棉网上,在棉花上滴加几滴水(如图2-11所示),观察发生的现象.
实验现象:棉花燃烧起来.
实验结论:过氧化钠与水反应,生成氧气和氢氧化钠的同时,还放出大量的热.
[注意] ①包在棉花内的过氧化钠不要太分散.
②加水不宜太多,当0.2 g过氧化钠参加反应时,加水约4滴.加水太多,会阻止棉花的燃烧;加水太少,过氧化钠反应不充分,生成氧气少,放出热量少,也不利于棉花的燃烧.
过氧化钠是强氧化剂,可以用来漂白织物、麦秆、羽毛等.
Ⅱ过氧化钠与二氧化碳的反应(难点)
过氧化钠跟二氧化碳起反应,生成碳酸钠和氧气:
2Na2O2+2CO2=2Na2CO3+O2
因此,它用在呼吸面具上和潜水艇里作为氧气的来源.
小结 Na2O和Na2O2的比较如下表:
Na2O和Na2O2的比较(重点)
|
化学式 |
Na2O |
Na2O2 |
|
结构 |
离子化合物 |
离子化合物 |
|
由Na+和O2-构成 |
由Na+和O2-2(过氧根离子)构成 |
|
|
氧元素的化合价为-2价 |
氧元素的化合价为-1价 |
|
|
类别 |
碱性氧化物 |
不是碱性氧化物(过氧化物) |
|
颜色、状态 |
白色固体 |
淡黄色固体 |
|
与H2O |
Na2O+H2O=2NaOH |
2Na2O2+2H2O=4NaOH+O2↑ |
|
与CO2反应 |
Na2O+CO2=Na2CO3 |
2Na2O2+2CO2=2Na2CO3+O2 |
|
与酸反应 |
Na2O+2HCl=2NaCl+H2O |
Na2O2+2HCl=2NaCl+H2O2(类似盐与酸反应) 2H2O2=2H2O+O2↑ |
|
与SO2反应 |
Na2O+SO2=Na2SO3 |
Na2O2+SO2=Na2SO4 Na2O2中氧元素的化合价为-1价,Na2O2既有氧化性又有还原性,以氧化性为主. |
|
存放 |
密闭、隔绝空气和水 |
|
|
制备 |
6Na+2NaNO2 4Na2O+N2↑ 2Na+O2 4Na2O+N2↑ 2Na+O2 Na2O2 Na2O2 |
|
|
鉴别 |
加水能产生使带火星木条复燃的气体的是Na2O2 |
[说明] ①Na2O2的结构:Na2O2是按阳离子、阴离广的个数比为2:1组成的氧化物,其阴离子叫过氧根,因此,Na2O2叫过氧化钠.Na2O2中的氧原子为-1价.
②Na2O2与H2O反应的实质:
Na2O2+2H2O=2NaOH+H2O2(非氧化还原反应)
2H2O2=2H2O+O2↑(氧化还原反应)
总化学方程式:2Na2O2+2H2O=4NaOH+O2↑
可见,还原产物是H2O,而不是NaOH.

③Na2O2具有漂白性
Na2O2具有很强的氧化性,能将有色物质氧化为五色物质,属于永久性漂白,不可复原,与SO2的漂白原理不同.
④过氧化钠不是碱性氧化物
Na2O2是钠的一种氧化物.从其组成看,属于金属氧化物;从其性质看,它可以与水反应生成碱,除此之外还生成O2.但是Na2O2不是碱性氧化物,它的类别属于过氧化物.
将Na2O2的性质与碱性氧化物的通性进行比较.
a.碱性氧化物可以有其相对应的水化物--碱.这里所说的“对应”,不仅指有关元素必须相同,更是指有关元素在氧化物和水化物中的化合价必须相同.对于可溶性碱来说,可由对应的碱性氧化物直接与水化合而生成;Na2O2虽然可与水直接反应,但反应结果并非只有碱一种物质生成,Na2O2中氧元素的化合价(-1价)与氢氧化钠中氧元素的化合价(-2价)也不相同.
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
b.碱性氧化物可以与酸性氧化物反应生成含氧酸盐,在反应前后各元素的化合价也没有改变,不存在电子转移.例如,Na2O与CO2的反应:
Na2O+CO2=Na2CO2
Na2O2与CO2的反应,虽然也是与酸性氧化物反应,但反应前后氧元素的化合价有所改变,存在着电子转移的过程.Na2O2在反应中既是氧化剂又是还原剂:
2Na2O2+2CO2=2Na2CO3+O2
c.碱性氧化物可以与酸反应生成盐和水,这是复分解反应.但是,由于Na2O2具有强氧化性,反应产物与酸有无较强的还原性有关,这与碱性氧化物的特性无关.例如,H2SO4在反应中不表现还原性,浓盐酸在反应中有较强还原性,其反应情况为:
Na2O+H2SO4=Na2SO4+H2O
Na2O+2HCl=2NaCl+H2O
Na2O2+H2SO4=Na2SO4+H2O2
2H2O2=2H2O+O2↑
Na2O2+4HCl(浓)=2NaCl+2H2O+Cl2↑
由以上分析可知:Na2O2并不是碱性氧化物.从其结构也可得知:Na2O2中并不存在O2-,而是存在O2-2.Na2O2不是普通的氧化物,不属于碱性氧化物.
⑤“过、高、亚、次”等字的用法
a.在化学命名上,“过”字附加在字首是表示含有过氧键“-O-O-”(O2-2)的化合物.如:过氧化钠(Na2O2)、过氧化氢(H2O2)、过氧化钡(BaO2)等,由于均含有两个氧原子直接相连的过氧键“-O-O-”(O2-2),因而称之为过氧化物.
应该指出,有些氧化物分子中含有两个氧原子,但它们并不形成过氧键,因而不能称为过氧化物。如:二氧化碳(CO2)、二氧化锰(MnO2)等.
b.在化学命名上,“高”“亚”“次”等,常用以表示化合物中某主要组成元素价态的高低,或者某种原子数目的多少.例如,某元素能生成几种含氧酸时,则以其中较稳定而常见的酸为标准,叫做“某酸”;比“某酸”多含一个氧原子的酸叫“高某酸”;比“某酸”少含一个氧原子的酸叫“亚某酸”,再少含一个氧原子的酸叫“次某酸”.如:
高氯酸 氯酸 亚氯酸 次氯酸(其中氯元素价态不同)
磷酸 亚磷酸 次磷酸(其中磷元素价态不同)
知识点2 碳酸钠和碳酸氢钠
Ⅰ碳酸钠和碳酸氢钠与盐酸的反应
实验2-6:碳酸钠和碳酸氢钠与盐酸反应的实验
实验目的:探究碳酸钠、碳酸氢钠跟盐酸反应快慢的情况.
实验原理:NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
实验用品:试管、气球、10 mL量筒、药匙、碳酸钠、碳酸氢钠、稀盐酸.
实验步骤:在两支试管中分别加入稀盐酸,将两个分别装有0.3 g Na2CO3、 NaHCO3粉末的小气球分别套在两支试管口,将气球内的Na2CO3和NaHCO3同时倒入试管中,比较它们放出CO2的快慢(如图2-12所示).
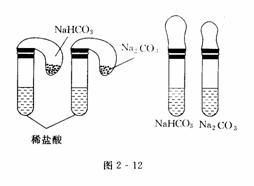
实验现象:混合后都生成无色气体,气球体积膨胀;气球内所装粉末分别与盐酸混合后,原来装碳酸氢钠的气球膨胀得较快,并且较大.
实验结论:碳酸氢钠和碳酸钠都与稀盐酸反应生成二氧化碳气体,跟酸反应时,碳酸氢钠比碳酸钠更容易生成二氧化碳气体,等质量的碳酸氢钠生成的CO2多些.
[注意] ①试管与气球的组合体要预先检查其气密性,气密性合格后才能使用.
②两组实验所用的盐酸要体积相同、浓度相同.
③要同时把两组实验的气球中的粉末和盐酸混合.
Ⅱ碳酸钠和碳酸氢钠的热稳定性
实验2-7:碳酸钠和碳酸氢钠的热稳定性实验
实验目的:比较碳酸钠和碳酸氢钠的热稳定性,并学会鉴别它们的方法.
实验原理:碳酸钠很稳定,加热到熔点(857℃)以上才缓慢地分解.碳酸氢钠却不稳定,在150℃左右分解放出二氧化碳,温度越高分解越快.
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
利用它们热稳定性的差异,可以鉴别这两种物质.
 实验用品:试管、小烧杯、酒精灯、无水碳酸钠、碳酸氢钠、澄清石灰水.
实验用品:试管、小烧杯、酒精灯、无水碳酸钠、碳酸氢钠、澄清石灰水.
实验步骤:在两支干燥的试管里分别放入约占试管容积1/6的无水碳酸钠和碳酸氢钠,按如图2-13所示装置装配两套仪器.并往烧杯里倒入半杯澄清的石灰水.加热,观察澄清的石灰水是否起变化.把试管拿掉,换上装有碳酸氢钠的试管,再加热,观察澄清的石灰水所起的变化.
实验现象:加热不久,盛碳酸氢钠的试管口处有水珠出现,导气管口有连续的气泡冒出,澄清的石灰水变浑浊.盛碳酸钠的试管内,除刚加热时因空气受热而从导气管口逸出几个气泡外,没有变化.
实验结论:碳酸钠受热没有变化,碳酸氢钠受热分解,放出二氧化碳:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
CO2+Ca(OH)2=CaCO3↓+H2O
碳酸钠很稳定,碳酸氢钠不稳定,受热容易分解.这个反应可以用来鉴别碳酸钠和碳酸氢钠.
[注意] ①被加热的试管要内、外干燥,固定在铁架台上时,试管口应略向下倾斜,铁夹夹在距试管口约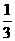 处.
处.
②在装入碳酸盐之前要检查实验装置的气密性,只有气密性合格时才能使用.
③固体粉末在试管内要铺平而不要过于堆积.
④加热时要用酒精灯的外焰,要先对试管底部均匀预热,之后再对准盛有药品的部位加热.
⑤实验结束时要先移走烧杯再熄灭酒精灯,防止发生倒吸现象引起试管炸裂.
⑥石灰水应是饱和、澄清的,其体积以占烧杯容积的 ~
~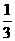 为宜.
为宜.
思维拓展
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com