
题目列表(包括答案和解析)
14.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是 ( )
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
13.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
12.化学反应N2+3H2 = 2NH3的能量变化如图所示,该反应的热化学方程式是 ( )
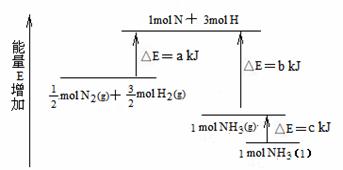
A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b-a)kJ·mol-1
C.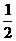 N2(g)+
N2(g)+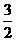 H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
H2(g) = NH3(l) ;⊿H = (b+c-a)kJ·mol-1
D.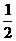 N2(g)+
N2(g)+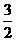 H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1
H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-1
11.下列关于热化学反应的描述中正确的是 ( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的
△H=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
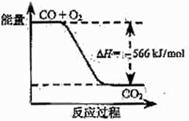
10.已知:2CO(g)+O2(g)=2CO2(g); ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 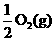 ;ΔH=-226 kJ/mol
;ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是 ( )
 A.CO的燃烧热为283
kJ
A.CO的燃烧热为283
kJ
B.右图可表示由CO生成CO2的反应过程和能
量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)
ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,
电子转移数为6.02×1023
9.已知:(1)Zn(s)+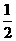 O2(g)====ZnO(s),△H=-348.3kJ/mol
O2(g)====ZnO(s),△H=-348.3kJ/mol
(2)2Ag(s)+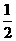 O2(g)====Ag2O(s),△H=-31.0kJ/mol
O2(g)====Ag2O(s),△H=-31.0kJ/mol
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为 ( )
A.Zn(s)+Ag2O(s)====ZnO(s)+2Ag(s),△H=317.3kJ/mol
B.Zn+Ag2O=====ZnO+2Ag,△H=317.3kJ/mol
C.Zn(s)+Ag2O(s)=====ZnO(s)+2Ag(s),△H=-317.3kJ/mol
D.2Zn(s)+2Ag2O(s)=====2ZnO(s)+4Ag(s),△H=-317.3kJ
8.已知反应:①25℃、101 kPa时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1 ②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1 下列结论正确的是 ( )
A.N2H4的燃烧热大于534 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量
7.在相同条件下,下列三个热化学方程式中△H比较正确的是 ( )
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H2
(3)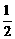 CH4(g)+O2(g)=
CH4(g)+O2(g)=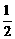 CO2(g)+H2O(g);△H3
CO2(g)+H2O(g);△H3
A.△H1<△H2<△H3 B.△H1>△H2,△H3=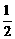 △H1
△H1
C.△H1=△H2=△H3 D.无法比较
6.根据热化学方程式:S(s) + O2(g) === SO2(g);△H=-297.23kJ·mol-1,分析下列说法中正确的是 ( )
A.S(g)+O2(g)=SO2(g);△H=-Q,Q的值大于297.23kJ·mol-1
B.S(g)+O2(g)=SO2(g);△H=-Q,Q的值小于297.23kJ·mol-1
C.1molSO2的键能总和等于1molS和1molO2的键能总和
D.1molSO2的键能总和小于1molS和1molO2的键能总和
5.对可逆反应4NH3(g)+5O2=4NO(g)+6H2O(g),下列叙述正确的是 ( )
A.达到化学平衡时,4V正(O2)=5V逆(NO)
B.若单位时间内生成XmolNO的同时,消耗XmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.加入催化剂,正反应速率增大,逆反应速率减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com