
题目列表(包括答案和解析)
17.(10分) 座位号:
(1) ____________________ _______________
(2) ___________________________________________________
(3) ________是正极,正极反应式:_____________ _________
________是负极,负极反应式:______________________
21.(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ===== 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
天水市一中2010级2010-2011学年第二学期第一学段理科答题卡
化 学
20.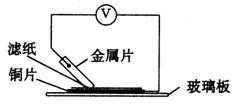 (10分)将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。
(10分)将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。
在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
|
金属 |
电子流动方向 |
电压/V |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请根据表中数据回答下列问题。
(1)__________金属可能是最强的还原剂;_______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
负极: _______________________; 正极: ________________________。
19.(10分)有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1) A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。


在b电极上发生的反应可表示为:PbO2+4H++SO +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为____________________________________。


(甲) (乙)
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是___________________________________。
18.(12分)A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1) )画出D元素的原子结构示意图____________。
(2)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式,下同)、阳离子是____________、阴离子是 。
(3) B的最高价氧化物对应的水化物中含有化学键的类型是____________。
(4) D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为__________________________________________。
17.(10分)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2 +CuCl2
(1)根据两反应本质,判断能否设计成原电池___________________________________
(2)如果不能,说明其原因___________________________________________________
(3)如果可以,请写出正负极材料名称和电极反应式。
________是正极,正极反应式:______________________
________是负极,负极反应式:______________________
16.在离子 RO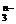 中, 共有x个核外电子,R 原子的质量数为 A,则R原子核内含有的中子数目是(
)
中, 共有x个核外电子,R 原子的质量数为 A,则R原子核内含有的中子数目是(
)
A.A-x+n+48 B.A-x+n+24
C.A-x-n-24 D.A+x-n-24
15.A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B C.C>B>A D.B>C>A
14.在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8 mol /L和5.4 mol /L,在一定的条件下它们反应生成NH3,10 min后测得N2的浓度是0.8 mol /L,则在这10 min内用NH3来表示的平均反应速率是( ) *ks*5*u
A.0.1 mol /(L·min) B.0.2 mol /(L·min)
C.0.3 mol /(L·min) D.0.6 mol /(L·min)
13.下面关于化学反应的限度的叙述中,正确的是( )
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com