
题目列表(包括答案和解析)
31.(12分)下列共有十四种化学符号:
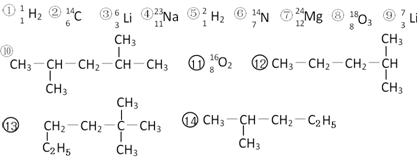
其中:
(1)表示核素的符号共有 种;
(2)互为同位素的是 (填序号,以下相同);
(3)中子数相等,但质子数不相等的是 ;
(4)有机物中是同一种物质的是 ;
(5)⑩的一氯代物的同分异构体数目: ;⒀的一氯代物的同分异构体数目: 。
30.可逆反应:3A(气)
 3B(?)+C(?);开始向容器中冲入A,随着反应的进行,气体平均相对分子质量变小,则下列判断正确的是 ( )
3B(?)+C(?);开始向容器中冲入A,随着反应的进行,气体平均相对分子质量变小,则下列判断正确的是 ( )
A.B和C可能都是固体 B.B和C一定都是气体
C.B和C不可能都是气体 D.若C为固体,则B一定是气体
第Ⅱ卷(选择题,共4题,50分)
29.某有机物分子中含有两个CH3-,一个-CH2-,一个和一个-Cl,该有机物可能的结构简式有( )
A.1种 B.2种 C.3种 D.4种
28.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是
A.负极反应为:14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.理论上消耗1mol C2H6,电路上转移的电子为14mol
 D.放电过程中,K+向负极移动
D.放电过程中,K+向负极移动
27.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的负极
C.电解质溶液中的阴离子向通氯气的电极移动
D.通氯气的电极反应为Cl2+2e-=2Cl-
26.由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为:( )
A.0.1mol B.等于0.2 mol
C.大于或等于0.2mo1,小于0.3mol D.大于0.1mol小于0.3mol
25. 对于密闭容器中的反应:N2(g)+3H2(g)
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是:
2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是:
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.点c处氢气与氨气的物质的量浓度一样
24.将6mol A和5mol B两气体通入容积为4L的密闭容器,一定条件下反应:3A(气)+B(气) 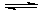 2C(气)+xD(气)+Q经5min达平衡,此时生成2mol C,测得D的平均反应速率为0.1mol·(L·min)-1,下列说法中正确的是( )
2C(气)+xD(气)+Q经5min达平衡,此时生成2mol C,测得D的平均反应速率为0.1mol·(L·min)-1,下列说法中正确的是( )
A.若降低该平衡体系的温度,则逆反应速率减小,正反应速率增大
B.恒温下,当容器中C和D的生成速率达到相等时,该反应达到平衡状态
C.A的平均反应速率为0.15mol·(L·min)-1
D.达平衡时B的转化率为25%
23.有一种无色的混合气体可能由CH4、NH3、、H2、CO、CO2 和HCl组成。为确定其组成,依次进行了以下实验:①将此混合气体通过浓硫酸,气体总体积基本不变。②再通过过量的澄清石灰水,未见浑浊,但气体体积减少。③把剩余气体在供氧的情况下燃烧,燃烧产物不能使无水硫酸铜变色。原混合气体一定含有:( )
A.CO和HCl B.CH4和NH3 C.CH4和HCl D.H2和CO2
22.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是( )
A.反应①、②中消耗等量的O2转移电子数目相等
B.反应①发生电化学腐蚀O2被氧化作正极
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com