
题目列表(包括答案和解析)
3、元素的性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子序数依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
|
|
D |
|
|
A |
B |
C |
|
|
E |
|
1、在元素周期表中前四周期的五种主族元素的位置关系如图所示,若B元素的核电荷数为Z,则五种元素的核电荷数之和为
A.5Z B.5Z+8 C.5Z+10 D.5Z+18
2、不符合原子核外电子排布基本规律的是
A.电子总是优先排在能量较低的电子层上 B.最外层最多可容纳的电子数为8
C.次外层最多可容纳的电子数为18 D.各电子层(n)最多可容纳的电子数为n2
25.
(1)31,15 (每空1分)
(2)第三周期,第ⅤA族,磷(每空1分)
24.(每空2分,总分18分。)
(1) C+H2SO4(浓)=CO2↑+SO2↑+H2O
(2)_ 4__→__2__→___1 _→__ 3 __。(2分)
(3) 检验产物中是否含有SO2 吸收SO2
过氧化氢或者溴水或者氯水 检验SO2是否完全除净
(4) 无水硫酸铜 H2O
若在1、3后则无法检验水是否是生成物
三计算题。(总分5分)
23. (每空1分,总分5分。)
(1) A
(2) C
(3) E
(4) A
(5) A D
22. (总分12分。)
(1)__ F ____ ___ K ___ ____ Br __ (每空2分)
(2) ;(2分)
;(2分)
(3)__HF____>__HCl____>_H2S___(填写化学式,2分);
(4)__HClO4___>___H2SO4___。(2分)
21.(每空2分,总分10分。)
(1) O
(2) Ⅷ
(3) 1
(4) 质子数和中子数
(4) 最外层电子数
25. (5分)某元素R,其原子核内有16个中子,已知其最高正价与负价绝对值之差为2,其气态氢化物含R 91.2%。
(1)求R的相对原子量,R质子数
(2)推断R在周期表中的位置,指出其名称。
宁海县正学中学2010学年第二学期第一次阶段性测试高一化学答题卷
一 选择题。(每小题只有一个选项符合题意。1-10每题2分,11-20题每题
3分,总分是50分。)
二 填空题。(总分45分)
24. (18分)(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:
________________________________________________________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):____→____→____→____。
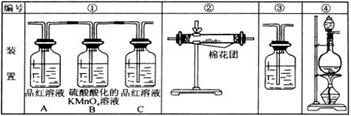
(3)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用_________,
B瓶溶液的作用是_______,可用_______代替,C瓶溶液的作用是________________。
(4)装置②中所加的固体药品是____________,可验证的产物是____________确定装置②在整套装置中位置的理由是______________。
23. (5分) 硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性 C、吸水性 D、脱水性 E、强氧化性
(1)实验室制CO2气体_______ _;
(2)干燥H2、SO2等气体__ _ _____;
(3)用铝槽车装运浓硫酸_______ _;
(4)清洗镀件表面氧化物_______ _;
(5)浓硫酸使湿润石蕊试纸变红,后来又变黑__ ______
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com