
题目列表(包括答案和解析)
18、T℃时在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示。则下列结论正确的是 ( )
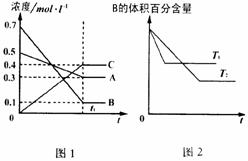 A.在达平衡后,保持其他条件不变,增大压强, 平衡向逆反应方向移动
A.在达平衡后,保持其他条件不变,增大压强, 平衡向逆反应方向移动
B.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.T℃时,若由0.4mol·L –1A、0.4mol·L –1B、0.2mol·L –1C反应,达到平衡后,C的浓度为0.4mol·L –1
D.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
17、将2molSO2和2molSO3气体混合于固定容积的密闭容器中,在一定条件下发生反应:2SO2 + O2
 2SO3平衡时,SO3为nmol,相同温度下,分别按下列配比在相同容积的密闭容器中放入起始物质,平衡时,SO3的物质的量大于nmol的是( )
2SO3平衡时,SO3为nmol,相同温度下,分别按下列配比在相同容积的密闭容器中放入起始物质,平衡时,SO3的物质的量大于nmol的是( )
A.2molSO2和1molO2 B.4molSO2和1molO2
C.2molSO2、1molO2和2molSO3 D.3molSO2和1molO2
16、常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:[N2O4(g)
 2NO2(g) △H>0](a)将两容器置于沸水中加热;(b)在活塞上都加2kg的砝码。在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
2NO2(g) △H>0](a)将两容器置于沸水中加热;(b)在活塞上都加2kg的砝码。在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
15、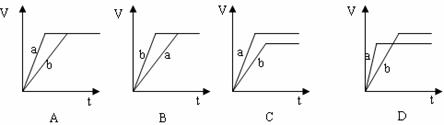 等浓度、等体积的两份稀硫酸a和b中,分别加入过量的锌粉,并向a中加入少量铜粉,下图表示产生H2的体积(V)与时间(t)的关系正确的是( )
等浓度、等体积的两份稀硫酸a和b中,分别加入过量的锌粉,并向a中加入少量铜粉,下图表示产生H2的体积(V)与时间(t)的关系正确的是( )
14、反应3A(g)+B(g) 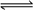 2C(g)+2D(g)在不同条件下,反应速率分别为
2C(g)+2D(g)在不同条件下,反应速率分别为
①v(A)=0.6 mol·L-1·min-1 ②v(B)=0.45 mol·L-1·min-1 ③v(C)=0.015 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·min-1则此反应在不同条件下进行得最快的是( )
A.②③ B.①③ C.②④ D.①
13、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: 负极 Pb+SO42--2e-→PbSO4 正极 PbO2+4H++ SO42-+2e-→PbSO4+2H2O
今若制得Cl20.10mol,这时电池内消耗的H2 SO4的物质的量至少是( )
A.0.20 mol B.0.050 mol C.0.10 mol D.0.025 mol
12、已知:①CO(g)+H2O(g)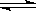 CO2(g)+H2(g);△H1= -
41.2kJ/mol
CO2(g)+H2(g);△H1= -
41.2kJ/mol
②CH4(g)+CO2(g)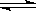 2CO(g)+2H2(g);△H2= +
247.3kJ/mol
2CO(g)+2H2(g);△H2= +
247.3kJ/mol
 ③CH4(g)+H2O(g)
③CH4(g)+H2O(g)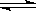 CO(g)+3H2(g);△H3
CO(g)+3H2(g);△H3
若反应③在体积一定的密闭容器中进行,测得CH4的物质的量随反应时间的变化如右图所示。下列有关叙述错误的是( )
A.△H3= + 206.1 kJ/mol
B.反应③进行到10min时,改变的外界条件可能是升高温度
C.反应③进行的过程中,0~5min这段时间共吸收的热量为103.05kJ
D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
11、已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
10、下列各组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是( )
A.食盐和蔗糖溶于水 B.氯化钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
9、在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:
P4(s) + 5O2(g) = P4O10(s) ΔH= -3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s) ΔH = -2954.0 kJ·mol-1 由此判断下列说法正确的是( )
A.红磷的燃烧热为2954.0 kJ·mol-1
B.已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′
C.由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高
D.等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com