
题目列表(包括答案和解析)
19、(10分)填空:(填编号)
A.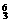 Li B.
Li B. N
C.
N
C. Na
D.
Na
D. Mg E.
Mg E. Li F.
Li F. C G.C60 H .CH3CH2COOH I.HO-CH2CH2-CHO J.金刚石 K. P4 L.SiO2 M.NH4Cl
C G.C60 H .CH3CH2COOH I.HO-CH2CH2-CHO J.金刚石 K. P4 L.SiO2 M.NH4Cl
(1) 和 互为同位素;
(2)中子数相等,但不是同一种元素的是 和 ;
(3) 和 互为同素异形体, 和 互为同分异构体。
(4)熔化时需要破坏共价键的是 ;晶体中既有离子键又有共价键的是 。
27、随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 CO2(g)+3H2(g)
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H= - 49.0kJ·mol-1测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H= - 49.0kJ·mol-1测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①写出该反应的平衡常数表达式:K=__________。
根据已知判断该反应的平衡常数的大小:
K(300℃) K(350℃)(填写“>”或“=”或“<”)。
②从反应开始到平衡,以氢气表示的平均反应速率v(H2)=____________mol·L-1·min-1。
③反应达到平衡后,第10分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”)。
④能说明该反应已经达到平衡状态的是___________。
A.3v逆(H2)=v正(H2O) B.容器内压强保持不变
C.c(CO2)=c(CH3OH) D.容器内的密度保持不变
⑤下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.加入适当的催化剂
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2,科研工作者通过某种电化学装置实现了上述目的。该电化学装置内的总反应为:2CO2=2CO+O2,阴极反应式为:2CO2+4e-+2H2O=2CO+4OH-,则阳极反应为:____________。该反应产生的CO会对环境产生污染,有人提出,通过加强热使CO分解的方法来消除污染,请你判断是否可行?_____(填“可或否”),说出理由:______________。 (已知反应2CO=2C+O2的△H>O、△S<O)
26、下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O

①请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
②请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
25、 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)
(5)强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向50mL0.55mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是 ( )
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1<△H2<△H3 D.△H1>△H3>△H2
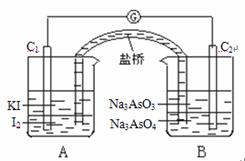
24、已知可逆反应:AsO43-+2I-+2H+ AsO33-+I2+H2O
AsO33-+I2+H2O
据此设计出如下图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下两此操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
(Ⅱ)若改向(B)烧杯中滴加40% NaOH溶液,发现微安表指针向前述相反方向偏转.
 试回答下列问题:
试回答下列问题:
(1)两次操作过程中指针偏转方向为什么相反?_____________________。
(2)(Ⅰ)操作过程中,C1棒为________极,此时,C1棒电极反应为_______________
(3)(Ⅱ)操作过程中,C2棒为________极,此时,C1棒电极反应为_______________
23、A、B、C、D、E五种元素,它们的原子序数依次增大。A原子最外层有4个电子;B的阴离子和C的阳离子跟氟离子的电子层结构相同;E原子的M电子层上的电子数比次外层电子数少1个;常温常压下,B的单质是气体,0.1molB的单质与氢气完全反应时,有2.408×1023个电子发生转移;C的单质在高温下与B的单质充分反应后,生成了淡黄色固体F,F与AB2反应后可生成B的单质;D的氢化物的分子式是H2D,D的最高价氧化物中含有40%(质量)的D,而且D原子核内质子数与中子数相等。根据上述条件判断:
(1)画出E离子的结构示意图:________________。
(2)D在元素周期表中属于第________周期,________族。
(3)F的电子式为:__________,F是由 键构成的 化合物(填“共价”或“离子”)。
(4)用电子式表示AB2的形成过程:_______________________;AB2的结构式:___________;AB2是由_______键构成的 分子(填“极性”或“非极性”)。
22、 右图是某同学设计的验证原电池和电解池的实验装置,下列有关说法不正确的是( )
右图是某同学设计的验证原电池和电解池的实验装置,下列有关说法不正确的是( )
A.关闭K2、打开K1,试管内两极都有气泡产生
B.关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为负极,b为正极
C.关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则a为负极,b为正极
D.关闭K2,打开K1,一段时间后,再关闭K1,打开K2,电流计指针不会偏转
21、镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
20、下列各组物质的颜色变化,可用勒夏特列原理解释的是( )
①氯水在光照下颜色变浅 ②H2、I2、HI平衡混合气体加压后颜色变深 ③氯化铁溶液加铁粉振荡后颜色变浅 ④NO2、N2O4平衡混合气体降温后颜色变浅
A.①② B.②③ C.①④ D.③④
19、反应PCl5(g)  PCl3(g)+Cl2(g) ①
PCl3(g)+Cl2(g) ①
2HI(g)  H2(g)+I2(g)
②
H2(g)+I2(g)
②
2NO2(g)  N2O4(g)
③
N2O4(g)
③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变 B.均增大 C.①增大,②不变,③减少 D.①减少,②不变,③增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com