
题目列表(包括答案和解析)
5、随着核电荷数递增,下列关于F、Cl、Br、I性质的比较,不正确的是
A. 单质的颜色逐渐加深 B. 单质与氢气化合的剧烈程度逐渐减弱
C. 阴离子的半径逐增大 D. 阴离子的还原性逐渐减小
4、下列各组物质中,互为同位素的是
A. 重氢、超重氢 B. 水、重水 C. 氧气、臭氧 D. 冰、干冰
3、下列性质可以证明某化合物中一定存在离子键的是
A. 可溶于水 B. 具有较高的熔点 C. 水溶液能导电 D. 熔融状态能导电
2、
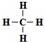 以下化学用语使用不正确的是
以下化学用语使用不正确的是
A. Cl原子结构示意图: B. 甲烷的结构式:
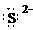
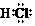 C. 硫离子的电子式:
D. 氯化氢的电子式:
C. 硫离子的电子式:
D. 氯化氢的电子式:
1、下列措施无法控制温室气体排放的是
A.提倡水力、潮汐、风能发电 B.开发氢气、硅等作为新型燃料
C.对煤炭进行脱硫后做燃料 D.研究开发以太阳能电池为动力的家用轿车
24、目前世界上比较先进的电解制碱技术是离子交换法,如图为阳离子交换膜法电解饱和食盐水的原理示意图。
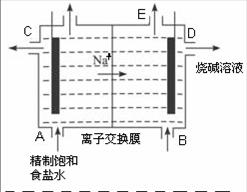
(1)下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),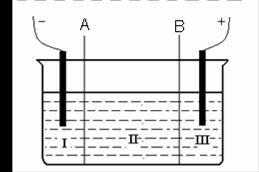
在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
23、(10分)在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g)  2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6,
2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6,
(1)达到平衡时,C的物质的量浓度; (2)以B表示的该反应的速率;
(3)达到平衡时,A的转化率。
22、(10分)请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。
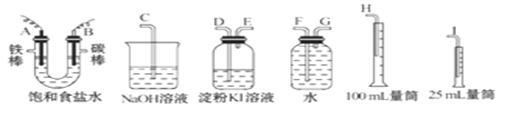
(1)A极发生的电极反应式是_____________ ______,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接______、 _____接______ ;B接_____ 、 _____接______ 。
(3)证明产物中有Cl2的实验现象是______ 。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为:_____ ___。
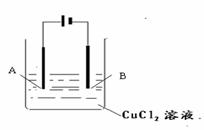
21、(6分)按右图所示装置,以石墨为电极电解氯化铜溶液。
(1)阴极为 (“A”或“B”),阴极电极反应式
(2)如要用电解的方法精炼铜,电解液选用CuSO4溶液,则阳极的材料是 (填写“粗铜”或“纯铜”)
阳极电极反应式为(不写杂质的) 。
20、(10分)短周期主族元素A、B、C、D的原子序数依次增大,A与D同主族,B与C在同一周期,B原子最外层电子数比C原子少2个, A、C单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质在常温下能剧烈反应生成A的单质。所得溶液滴入酚酞显红色。回答下列问题:
⑴ 写出元素符号A ,B ,C ,D 。
⑵ 写出B与C两种单质完全反应后所得生成物的电子式 ,该分子空间构型为 。
⑶ C、D两种单质在点燃条件下形成的化合物的电子式 ,判断其中的化学键的类型 。
 ⑷ 写出两种由A、B、C、D四种元素组成的化合物的化学式
、
。
⑷ 写出两种由A、B、C、D四种元素组成的化合物的化学式
、
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com