
题目列表(包括答案和解析)
29. 2L密闭容器中,充入1molN2和3molH2,在一定条件下发生 反应合成氨反应,2min时达到平衡。测得平衡混合气体中 NH3的体积分数为25%,则:
(1)v(NH3)= ;
(2)H2在平衡时的体积分数= ;(保留一位小数)
(3)平衡时容器的压强于起始时的压强之比 。
28.(14分)某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下:镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液。其设计的实验方案及部分实验现象如下表:
|
实验步骤 |
实验现象 |
|
①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
|
②将表面积大致相同的镁条和铝条(均已用砂纸打磨过),分别投入足量的相同体积的0.5mol/L的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
|
③将新制的氯水滴加到新制的Na2S溶液中 |
|
|
④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 |
均剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是 ,该反应的离子方程式为 。
(2)由实验③得出的实验结论是 。
(3) 由实验②可得出决定化学反应快慢的主要因素是 。
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确? (填“是”或“否”)。
(5)通过实验④说明要加快化学反应速率可 或 。
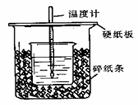
27.(10分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等、不相等”),简述理由
26.(13分)有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20;X、Z是金属元素;V和Z元素原子的最外层电子都只有一个;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可知:
(1)X在元素周期表中的位置是 ,其离子结构示意图表示为 。
(2)Y元素最高价氧化物对应水化物的分子式为 ,该物质与碳加热反应的化学方程式为 。
Z元素的最高价氧化物对应水化物的化学键类型是 。
(3)V与W形成的10电子分子的电子式 ,属于 分子.(填“极性或非极性”)
(4)Y与Z的化合物属于 化合物(填“离子”或“共价”), 用电子式表示该化合物的形成过程 。
25.(9分)(1)水的沸点较高,这是因为水分子之间存在 。已知0.5g氢气完全燃烧生成液态水时,放出热量60.5 kJ,则氢气燃烧热的热化学方程式为 ;氢气中1 mol H-H键断裂时吸收热量为436kJ,液态水中1 mol H-O键形成时放出热量463kJ,则氧气中1 mol
O=O键完全断裂时吸收热量为 kJ。
(2)甲烷-氧气燃料电池,该电池用金属铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气。
负极: ,电池总反应化学方程式: .
24.如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是

A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
23.下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反映的中和热△H=-57.3kJ/mol,
则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
22.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述
正确的是
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.134 |
0.089 |
0.102 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.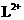 与
与 的核外电子数相等 B.L与T形成的化合物具有两性
的核外电子数相等 B.L与T形成的化合物具有两性
C.氢化物的稳定性为 D.单质与浓度相等的稀盐酸反应的速率为Q<L
D.单质与浓度相等的稀盐酸反应的速率为Q<L
21.下列说法正确的是
A. 由两种非金属元素的原子间形成的化学键都是极性键
B. 由两种元素的原子构成的共价化合物中,所有化学键都是极性键
C. 离子化合物中的化学键都是离子键
D. 凡是含有非极性键的分子必为非极性分子
20. 下列说法正确的是
A.在周期表中,族序数都等于该族元素的最外层电子数
B.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
C.卤素单质随原子序数的增大,其熔沸点逐渐降低
D.碱金属随原子序数的增大,其熔沸点逐渐降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com