
题目列表(包括答案和解析)
10.下列说法正确的是
A.化学反应既遵守“质量守恒”定律,也遵守“能量守恒”定律
B.HF、HCl、HBr、HI的的稳定性依次增强
C.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
D.两种原子,如果核外电子排布相同,则它们的关系为互为同位素
9.在石油工业发展的早期,乙烯和丙烯都曾被当着炼油厂的废气而白白烧掉,聚乙烯和聚丙烯的研制成功,使这些废弃物得到了充分利用。分析丙烯的加成聚合过程,指出描述聚丙烯的结构简式中正确的一项
A.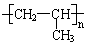
 B.
B.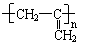

C.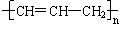
 D.
D.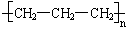

|
8.共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种相互作用的是( )
A.干冰 B.氢氧化钠 C. 氯化钠 D.碘
7.科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。下列4组物质:①Mg、O2 、N2、NO;②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2 、CO2、SiO2。从物质的基本分类看,每组中都有一种物质与其它物质不属于同一类,这4种物质分别是
A.Mg、Na2CO3、H2CO3、CaO B.O2、NaOH、H2SO4、SiO2
C.NO、CH4、NH3·H2O、CaO D.NO、KCl、H2SiO3、SO2
6.在一定条件下,ROn- 3与R2-发生如下反应: ROn- 3+2 R2-+6H+=3R+3H2O,下列关于元素R的叙述中正确的是
A.R原子的最外层上有4个电子 B.ROn- 3中的R只能被还原
C.HnRO3一定是强酸 D.R的单质既具有氧化性又具有还原性
5.一定物质的量SO2与NaOH溶液反应,所得产物中含Na2SO3和NaHSO3,则参加反应的SO2与NaOH的物质的量之比为可能为
A.1:1 B.1:2 C.3:5 D.2:1
4.取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷(methane)和半试管氯气,用铁架台固定好。放在光亮处一段时间。下列对观察到的现象的描述及说明正确的是
A.试管中气体颜色变浅,是因为发生了加成反应(acddition reacticon)
B.试管中有少量白雾生成,这是氯化氢的小液滴
C.试管内壁出现油状液体,这是甲烷与氯气的混合溶液
D.试管内壁出现油状液体,这是CH3Cl小液滴
3.除去SO2中的SO3,并得到纯净的SO2,最好使混合气体通过
A.水 B.NaHSO3饱和溶液
C.NaHCO3饱和溶液 D.98.3%浓硫酸
2.最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e- === 2MnO(OH)+2OH-
 F极:Zn+2NH4Cl
=== Zn(NH3)2Cl2+2H++2e-
F极:Zn+2NH4Cl
=== Zn(NH3)2Cl2+2H++2e-
总反应式:2MnO2+Zn+2NH4Cl === 2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
1.取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该试验,下列说法不正确的是
A.温度越高,镁与水反应的速率越快
B.镁与水反应的化学方程式为:Mg+2H2O === Mg(OH)2+H2↑
C.氢氧化镁显碱性,且在水中有一定的溶解性
D.氢氧化镁是离子化合物,它的碱性比同主族的氢氧化锶强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com