
题目列表(包括答案和解析)
25. (1)1/3mol
(2) 6Fe+20H++5NO3-==3Fe2++3Fe3++5NO↑+10H2O
24.(1)氧;第二周期第六主族
(2)Na;
(3)Na>S>O
(4)HClO4;NaOH
(5)OH-+H+=H2O
23. (每空3分) 1mol;3.36L
22. (1)(每空1分) A: NH4+ B: OH- C: NH3 D: H2O
(2)(2分)Al3++4OH-==AlO-+2H2O
21.(1)Cu+4HNO3==Cu(NO3)2+2NO2↑+2H2O
(2)可随用随制;二氧化氮被吸收,防止污染环境
(3)C ;a,b
(4)关闭ab打开c用热毛巾捂试管
25. 5.6gFe和一定量的稀硝酸恰好完全反应,生成一氧化氮气体,反应后的溶液加入0.25moL的氢氧化钠恰好使铁离子完全沉淀,
(1)则参加反应的硝酸的物质的量为
(2)写出总反应的离子方程式
24. X、Y、Z、W为原子序数依次增大的四种短周期主族元素,其中X、Z同族,W、Z同
周期, Y是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3
倍,W的最高正价与最低负价代数和为6。
(1)X元素的名称是 。该元素在周期表中的位置为
(2)Y元素符号是 Y元素的原子结构示意图为
(3)X、Y、Z三种元素按原子半径由大到小的顺序排列为 (用元素符号填空)
(4)X、Y、Z、W四种元素的最高价氧化物对应的水化物酸性最强的是
碱性最强的是 (用化学式填空)
(5)写出 Y元素的最高价氧化物对应的水化物和W元素的最高价氧化物对应的水化物反应的离子方程式
23.(6分)将19.2g的铜和某浓度的硝酸反应,生成8.96L(标况)的气体,则参加反应的硝酸为 moL,将这8.96L的气体和标况下 L的氧气混合,再通入水中没有气体剩余。
22.(6分)A、B、C、D、E五种微粒具有相同的电子数,它们之间能发生如下反应:
A+B=C+D;如果将B、D、E 混合B少量则有白色沉淀,B过量则无沉淀,请回答:
(1)用化学符号表示下列4种微粒:
A: B: C: D:
(2)写出B、D、E 混合B过量时的离子方程式:
21.下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
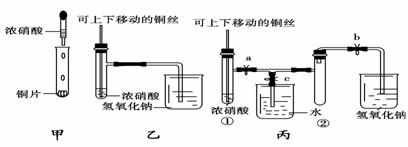
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是______________________
(2)和甲装置相比,乙装置的优点是①____________________;②
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹________,再打开弹簧夹________,才能使NO2气体充满试管②。
(4)当气体充满试管②后,将铜丝提起与溶液脱离,欲使烧杯中的水进入试管②应如何操作
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com