
题目列表(包括答案和解析)
21. (12分)Ⅰ.王亮在超市看到一种电池外壳的纸层包装印有右图的文字,请根据要求回答问题。
(12分)Ⅰ.王亮在超市看到一种电池外壳的纸层包装印有右图的文字,请根据要求回答问题。
(1)该电池的种类是________(填序号)。
①干电池 ②蓄电池 ③燃料电池
(2)该电池的负极材料是_______,含有的金属元素中毒性最大的是______(本小题写元素符号)。
(3)该电池的使用和性能,说法正确的是________
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
 C.该电池使用后不能投入火中,应埋入地下以防污染环境
C.该电池使用后不能投入火中,应埋入地下以防污染环境
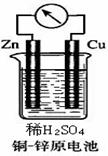
Ⅱ.如右图所示的铜-锌原电池中,理论上应观察到的现象是:
铜片: 锌片: 。
此时原电池的电极反应式是:
正极: 负极: 。
但在实际实验中,锌片上也有气泡产生(装置连接正常),其原因可能是
。
|
X |
|
|
Y |
Z |
20.下列关于原电池的叙述中,错误的是( )
A.原电池是将化学能转化为电能的装置
B.用导线连接的两种不同金属同时插入液体中,就能形成原电池
C.所有原电池的反应物都是装在电池中
D.在原电池中,电子流出的一极是负极,发生氧化反应
第II卷(共50分)
19.已知N2(g)+3H2(g)  2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )
A.在反应开始后的任何时刻,3v(N2)=v(H2)
B.达到化学平衡状态时,正反应和逆反应的速率都为0
C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2
D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化
18.下列化学用语书写正确的是( )
A.氯离子的结构示意图: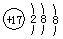
B.质量数为18的氧原子: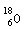
C.氯化镁的电子式: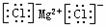
D.用电子式表示氯化氢分子的形成过程: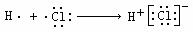
17.100 mL 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采取的措施有( )
A.加入Na2SO4固体 B.加入H2O C.加入CuSO4固体 D.把锌粉换成锌粒
16.下列说法中正确的是( )
A.在原电池中,较活泼的金属不一定作负极
B.对于任何反应,只要升高温度都能提高反应速率
C.对于任何反应,只要增加反应物的量都能提高反应速率
D.在合成氨的装置中,只要反应时间足够长,氮气的转化率可以达到100%
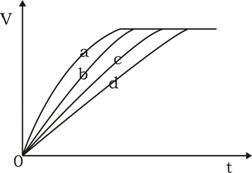
15.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到右下图,则曲线a所对应的实验组别是( )
|
组别 |
c(HCl)(mol·L-1) |
温度(℃) |
状态 |
|
A |
2.0 |
25 |
块状 |
|
B |
2.5 |
30 |
块状 |
|
C |
2.5 |
50 |
粉末状 |
|
D |
2.5 |
50 |
块状 |
14.下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
D.双氧水中加入少量MnO2,即可迅速放出气体
13.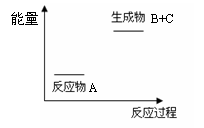 由右图分析,下列说法正确的是( )
由右图分析,下列说法正确的是( )
A.A=B+C与B+C=A两个反应吸收和放出的热量不等
B.A=B+C是放热反应
C.A具有的能量高于B和C具有的能量总和
D.A=B+C是吸热反应,B+C=A必然是放热反应
12.可逆反应A(g)+3B(g)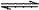 2C(g)+2D(g)在四种不同情况下反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g)在四种不同情况下反应速率分别如下,其中反应速率最大的是( )
A.v(A)=0.15 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.3 mol/(L·min) D.v(D)=0.1 mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com