
题目列表(包括答案和解析)
6.利用下列装置(部分仪器已省略),能顺利完成对应实验的是

5.下列有机反应化学方程式中,书写正确的是
A.实验室制取乙烯: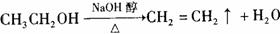
B.工业上制取聚丙烯: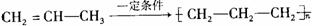
C.制硝基苯的反应: 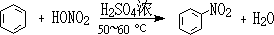
D.苯酚钠溶液中通入少量二氧化碳: 2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
4.下列各对物质中,互为同系物的是
A.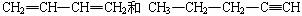
B. 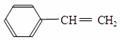 和 CH3-CH=CH2
和 CH3-CH=CH2
C. 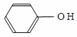 和
和 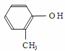
D.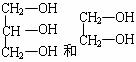
3.下列有机物命名正确的是
A. 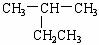 2-乙基丙烷 B.CH3CH2CH(OH)CH3 2-丁醇
2-乙基丙烷 B.CH3CH2CH(OH)CH3 2-丁醇
2.下列化学用语表达错误的是
A.乙醇分子的比例模型图:
 B.苯分子的最简式:CH
B.苯分子的最简式:CH
C.丙烯的结构简式:CH3CHCH2
D.甲基的电子式: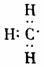
1.工业上获得大量的乙烯、丙烯、丁二烯采用的方法是
A.减压分馏 B.高温干馏 C.石油裂解 D.催化重整
25.(6分)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。已知2KMnO4 + 16HCl = 2KCl + 2MnCl2 +5Cl2↑ + 8H2O。


实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ. 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡
(1)A中产生黄绿色气体,其电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B、C中溶液发生反应的离子方程式是 。
(4)过程Ⅳ能证明溴的氧化性强于碘的现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下原子半径逐渐
(填“增大”或“减少”),得电子能力逐渐减弱。
东山中学2010-2011学年度高一第二学期中段考试
24.(8分)一定温度下在10L容器中加入5molSO2和3molO2,10min后反应达到平衡时,测得有50%的O2发生了反应,则:
(1)O2的反应速率为_______________。
(2)平衡时容器内气体的总物质的量为 ,平衡时SO2的转化率为 _______________________(该小题写出计算过程,转化率用百分数表示,并把结果填在横线上)。
23.(10分)(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。已知该反应为:2Fe3+ + 2I- = 2Fe2+ + I2。请完成相关的实验步骤和现象。
可选试剂:①0. 1mol·L -1KI溶液;②0. 1mol·L -1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L -1 KI溶液,再滴加5~6滴(约0.2ml)0. 1mol·L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂 (填试剂序号),若现象为 ,说明Fe3+有剩余,该反应有一定的限度。
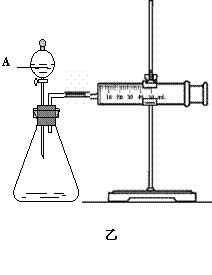 (2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
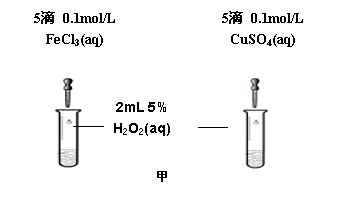
①定性分析:如图甲可通过观察 (填现象),定性比较得出结论。有同学提出将FeCl3溶液改为Fe3+浓度相同的Fe2(SO4)3溶液更为合理,其理由是 。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中一定需要测量的数据是 (填序号)。
①收集40ml气体所需要的时间
②CuSO4溶液和FeCl3溶液的浓度
③过氧化氢溶液的浓度
22.(14分)有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如下图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
(1)各元素的符号是:Y T U
(2)Y的阴离子结构示意图
(3)Z最高价氧化物对应的水化物是:
(4)T2X2和U2X反应的化学方程式 。
(5)写出T2X2的电子式:____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com