
题目列表(包括答案和解析)
26.(6分)0.15 mol/( L·s) 0.7 mol/L 30%(各2分)
25.(3分)(1)2︰1(1分) (2)CEF(2分)
24.(4分)NaCl H2S N2 NaOH(各1分)
30.(14分)已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。五种元素中A元素原子半径最小;B原子的最外层电子数是内层电子数的2倍;E元素与D元素同主族;E的单质为黄色固体,自然界中游离态的E常出现在火山口附近。
(1)请写出元素符号:B ;D 。
(2)画出E的阴离子结构示意图 。
(3)B、C两种元素对应的最高价含氧酸的酸性较强的是 (填化学式)。
(4)A元素的单质和C元素的单质在一定条件下反应,生成化合物X。 X 的电子式为 ,向X的水溶液中滴入石蕊试液,会观察到的现象是 。
(5)用电子式表示化合物BD2的形成过程 。
(6)向苛性钠溶液中通入过量的A2E气体时,所发生反应的离子方程式为 。
(7)化合物ED2与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式
为 。
牡一中2010-2011学年度下学期期中考试高一学年
化学试题答案
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
A |
B |
D |
A |
A |
C |
D |
A |
B |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
\\\\\\\\\ |
\\\\\\\\\ |
|
C |
B |
C |
B |
A |
C |
D |
C |
\\\\\\\\\ |
\\\\\\\\\ |
|
19 |
20 |
21 |
22 |
23 |
|
C |
A |
A |
D |
B |
29.(10分)某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
|
编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
|
① |
Mg、Al |
稀盐酸 |
偏向Al |
|
② |
Al、Cu |
稀盐酸 |
|
|
③ |
Al、C(石墨) |
稀盐酸 |
偏向石墨 |
|
④ |
Mg、Al |
氢氧化钠溶液 |
偏向Mg |
|
⑤ |
Al、Zn |
浓硝酸 |
偏向Al |
 (1)实验①、⑤中Al电极的作用是否相同
(填“是”或“否”);
(1)实验①、⑤中Al电极的作用是否相同
(填“是”或“否”);
(2)请在方框内画出实验③的原电池装置图,标出正、负极。
(3)实验②中电流计指针偏向 电极(填“Al”或“Cu”),Cu电极反应式为 ;
(4)实验④中铝为 极(填“正”或“负”), 其电极反应式为 。
28.(7分)已知溴单质的氧化性介于氯和碘之间,利用这一性质解决下面问题。
(1)下列物质或微粒中,在酸性条件下可能氧化Br-的是 (填序号)。
A.I2 B. MnO4- C.MnO2 D.Cl-
(2)把滤纸用淀粉和碘化钾的混合溶液浸泡、晾干后可获得实验常用的淀粉碘化钾试纸。这种试纸润湿后,遇少量氯气可观察到试纸变蓝,用化学方程式解释该现象: 。
(3)下列试剂不能把NaCl和KI两种无色溶液区别开的是 (填序号)。
A.氯水 B.溴水 C.淀粉溶液 D.稀硝酸
(4)100mL溴化亚铁溶液中通入3.36L氯气(标况),充分反应后测得溶液中氯离子与溴离子的物质的量浓度相等,则原溴化亚铁溶液的物质的量浓度为 。
27.(5分)硫代硫酸钠溶液与稀硫酸的反应方程式为:
Na2S2O3+H2SO4 = Na2SO4+S↓+SO2+H2O,
某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
甲 乙
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
|
实验 组号 |
温度 |
Na2S2O3溶液 |
H2SO4 |
加入H2O的体积 |
出现沉淀所需时间 |
||
|
体积 |
浓度 |
体积 |
浓度 |
||||
|
Ⅰ |
0℃ |
5mL |
0.1mol·L-1 |
10mL |
0.1mol·L-1 |
5mL |
8s |
|
Ⅱ |
0℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
12s |
|
Ⅲ |
30℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
4s |
结论1:由Ⅰ和Ⅱ两组数据可知 ;
结论2:由Ⅱ和Ⅲ两组数据可知 。
26.(6分)将4 mol SO2和2 mol O2在2 L的密闭容器中混合,在一定条件下发生如下反应:2SO2(g)+O2(g) 2SO3(g)。若经过2s后测得SO3的浓度为0.6 mol/
L,用氧气表示该反应2s内的平均速率V(O2)=
;2s末O2浓度为
;2s末SO2的转化率为
。
2SO3(g)。若经过2s后测得SO3的浓度为0.6 mol/
L,用氧气表示该反应2s内的平均速率V(O2)=
;2s末O2浓度为
;2s末SO2的转化率为
。
25.(3分)一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
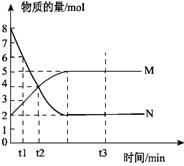
(1)此反应的化学方程式中a︰b=
(2)下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的平均摩尔质量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.在混合气体中N的质量百分数保持不变
24.(4分)在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又含有极性键的是 。(填化学式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com