
题目列表(包括答案和解析)
19. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
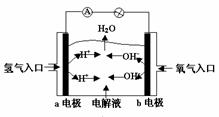
A. a电极是负极
B. b电极的电极反应为:4OH--4e-==2H2O+O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置
三:填空题
20:写出下列物质的电子式:(每小题1分,共4分)
(1) 硫化氢:
(2) 氧气:
(3) 氯化铵:
(4) 过氧化钠:
21:X,Y,Z,W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y﹑W均相邻,Y﹑Z和W三种元素的原子最外层电子数之和为17,且Z﹑W最外层电子数相同则:(每小题2分,共4分)
(1) 用电子式表示X与Y所组成化合物的形成过程
(2) W在周期表中的位置是
(3) 已知,在101kPa时,X单质在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,则表示X单质燃烧热的热化学方程式为__________ 。
22:盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
23:将铝片和镁片用导线连接插入氢氧化钠电解质溶液中,写出该装置中负极的电极反应式和总反应的离子方程式。
(1) 负极反应式
(2) 总反应离子方程式
四:问答题
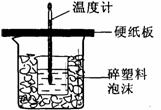 24:中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
24:中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;本装置的不足之处是 ;不加以改正,所求的值将
(填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
25:下表是元素周期表的一部分,回答下列有关问题
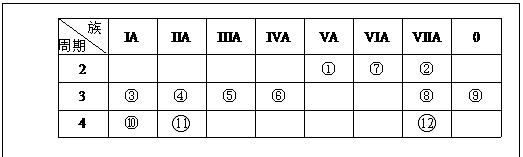 (1)写出下列元素符号:① ________,⑥ ________。
(1)写出下列元素符号:① ________,⑥ ________。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(用化学式表示)
(3)已知⑦的一种单质具有强氧化性,能使淀粉碘化钾式纸变蓝,化学方程式为,
O3+2KI+H2O=2KOH+I2+O2当生成1.27克碘时,转移的电子数为 .
26:铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 == 2PbSO4+ 2H2O,据此判断:
(1)铅蓄电池的负极材料是________。
(2)工作时正极反应为________________________________。
(3)工作时,电解质溶液的PH________(填“增大”、“减小”或“不变”)
(4)工作时,电解质溶液中阴离子移向________极;电流方向从________极流向________极。(填正,负)
27:火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.6KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
(3)肼与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20%---30%的氢氧化钾溶液,写出该电池放电时的电极反应:
正极
负极 。
鹤岗一中2010--2011学年度下学期期中考试
16、在同温同压下,下列各组热化学方程式Q2>Q1的是( ) A.2H2(g)+O2(g)=2H2O(l);△H=-Q1
2H2(g)+O2(g)=2H2O(g);△H=-Q2
B.S(g)+O2(g)=SO2(g);△H=-Q1
S(s)+O2(g)=SO2(g);△H=-Q2
C.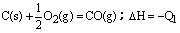
C(s)+O2(g)=CO2(g);△H=-Q2 D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1
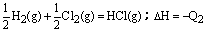
17:有a、b、c、d四种金属。将a与b用导线联接起来,浸入电解质溶液中,b不易腐蚀。将a、b分别投入等浓度盐酸中,d比a反应剧烈。将铜浸入b的盐溶液里,无明显变化。如果把铜浸入c的盐溶液里,有金属c析出。据此判断它们的活动性由强到弱的顺序是 ( )
A. dcab B. dabc C. dbac D. badc
18:以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+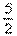 O2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是( )
A.有5NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
O2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是( )
A.有5NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
15.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是 ( )
12、实验室中欲加快制取氢气的速率,应采取的措施是 ( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.含铜、铅等杂质的粗锌与稀硫酸反应 D.粗锌与稀硝酸反应
13:下列说法正确的是( )
A元素周期表中每一个纵行就是一个族 B元素周期表共有18个族,只有主族和副族之分
C元素周期表有18个纵行,16个族 D元素周期表有8个 主族,8个副族
14:同主族两种元素原子的核外电子数的差值可能是( )
A 6 B 12 C 26 D 30
11、下列分子中所有原子都满足最外层8电子结构的是 ( )
A、光气(COCl2) C、六氟化硫
B、二氟化氙 D、三氟化硼
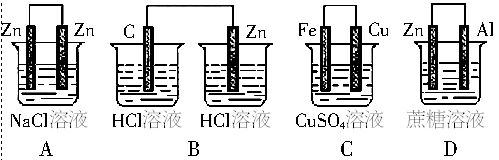
8、下列各图所示装置属于原电池的是( )
二:选择题(每小题只有一个正确选项,每小题3分,共33分)
9:下列微粒中半径最小的( )
A、 Na+ B、Al3+ C、K+ D、S2-
10: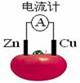 右图为番茄电池,下列说法正确的是( )
右图为番茄电池,下列说法正确的是( )
 A.一段时间后,锌片质量会变小 B.铜电极附近会出现蓝色
A.一段时间后,锌片质量会变小 B.铜电极附近会出现蓝色
 C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
30.(14分)
(1)C(1分) O (1分) (2)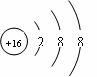 (1分)
(1分)
(3)HNO3(1分) (4)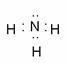 (2分) 紫色石蕊试液变蓝(2分)
(2分) 紫色石蕊试液变蓝(2分)
(5)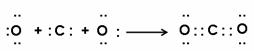 (2分)
(2分)
(6)H2S+OH-=HS-+H2O(2分)
(7)SO2+Cl2+2H2O=H2SO4+2HCl(2分)
29.(10分)(1)是(1分) (2) (3分)
(3)Cu(1分);2H++2e-=H2↑(2分)
(4)负(1分);Al-3e-+4OH-=AlO2-+2H2O(2分)
28.(7分)(1)BC (2分) (2) Cl2 +2 KI =2 KCl + I2(2分)
 (3)C (1分) (4)2mol/L(2分)
(3)C (1分) (4)2mol/L(2分)
27.(5分)(1)温度(1分)
(2)其它条件一定时,反应物浓度越大,化学反应速率越快(2分)
其它条件一定时,温度越高,化学反应速率越快(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com