
题目列表(包括答案和解析)
26.按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)我国发射的“神舟”六号载人飞船是采用先进的甲烷电池为电能的,该电池以KOH溶液为电解质,其总反应的化学方程式为:CH4 + 2O2 + 2OH-﹦CO32- +3H2O,则:
①负极上的电极反应为 ;
②当消耗标准状况下的O2 16.8升时,有 mol电子发生转移。
(2)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
25.在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末达到平衡且
测得容器中有1.6 mol SO2 ,回答下列问题:
(1)写出容器内发生反应的化学方程式 ;
(2)2 min内SO2的平均反应速率________________________。
(3)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
④容器内的压强恒定不变
(4)平衡时容器内的压强是开始的 倍。
24.将铁棒和锌棒用导线连接插入硫酸铜溶液中,当电池中有0.4 mol电子通过时,负极的质量变化是
A.增加6.5g B.减少5.6g C.增加11.2g D.减少13g
第Ⅱ卷 (非选择题,共52分)
说明:以下各题每空2分
23. 氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下: ①2H2 +4OH-+4e- = 4H2O,②O2+2H2O+4e- = 4OH- 当得到1.8L饮用水时,电池内转移的电子数约为
A.1.8mol B.3.6mol C.100mol D.200mol
22.对于铁、铜和稀硫酸组成的原电池(如右图),下列有关说法正确的是
①Fe是负极 ②电子由Fe经外电路流向Cu,后再通过溶液流回到Fe
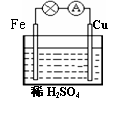 ③Fe -2e-=Fe2+ ④ H+ 在溶液中由Cu棒向Fe棒迁移
③Fe -2e-=Fe2+ ④ H+ 在溶液中由Cu棒向Fe棒迁移
⑤一段时间后溶液的PH变大 ⑥一段时间后溶液由无色变为浅绿色
A.①② B.①③⑤⑥ C.②③④ D.①②③④
21.设NA代表阿伏加德罗常数,下列说法正确的是
A.1.8gNH4+含有的电子数为1.1NA
B.在标准状况下,22.4LHF含有的原子数为2NA
C.2.4g Mg作为还原剂,失去的电子数为0.2NA
D.200mL0.5mol/LNaHCO3溶液中含有的钠离子数为NA
20.下列说法中正确的是
A.在由Fe、C、CuCl2溶液构成的原电池时,一段时间后Fe棒上将覆盖一层红色物质
B.熔融状态下能导电的物质一定是离子键化合物
燃烧 蒸汽 发电机
C.燃煤发电的能量转变过程可以表示为:化学能---→热能---→机械能---→电能
D.阴阳离子间通过静电引力而形成的化学键叫做离子键
19.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是
①使煤充分燃烧,提高煤能的利用率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A、①②③ B、②③④ C、①③④ D、①②③④
18.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g),若经 2 s(秒)后测得
C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
2C(g),若经 2 s(秒)后测得
C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
A. 用物质 A 表示的反应的平均速率为 0.3 mol∕(l·s)
B.用物质 B 表示的反应的平均速率为 0.3 mol∕(l·s)
C.2 s 时物质 A 的转化率为30%
D. 2 s 时物质 B 的浓度为 0.7 mol∕l
17. 右图是可逆反应X2 + 3Y2
右图是可逆反应X2 + 3Y2 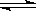 2Z2 在反应
2Z2 在反应
过程中的反应速率(V)与时间(t)的关系曲线,
下列叙述正确的是
A.t1时,只有正方向反应
B.t2时,反应到达限度且正反应和逆反应速率相等且等于零
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度均没有发生变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com