
题目列表(包括答案和解析)
18.(12分)某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
实验药品:2. 0moL/L盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属用量均为9. 0g。
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
|
2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
|
4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式 。
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(写出2种可能): 。
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃)。请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50. 0mL、铝为9. 0g过量):
|
实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L-1 |
|
1. 实验①和②探究盐酸浓度对该反应速率的影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响。 |
① |
25˚C |
铝片 |
4.
0 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
17.(12分)A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大,D、G同主族,A与B、C、D能形成电子数相同的二种常见分子,E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构。
(1)三种元素的名称。B ,D ,F 。
(2)A与D、A与G均可形成18e-的化合物。两种化合物在水溶液中反应的化学方程式为:
(3) A、D、E三种元素中的两种或三种形成的物质中,含有非极性键的离子化合物的电子式为: ;只含离子键的化合物的电子式为: 。
(4)E离子的半径 (填“大于” “小于”或“等于”) F离子的半径 ;E 和F元素最高价氧化物对应的水化物之间反应的离子方程式为: 。
(5)写出由上述各种元素形成的粒子中与BC-电子数相等的三种分子的化学式 、 。
16.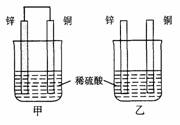 (8分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(8分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
15.1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5ASF6,下列叙述错误的
A.N5+共有24个核外电子
B.N5+中N-N原子间以共用电子对结合
C.化合物N5ASF6中As化合价为+l价
D.化合物N5ASF6中F化合价为-1价
第II卷(非选择题共40分)
14.石墨在一定条件下转化为金刚石时,要吸收能量。下列说法正确的是
A.金刚石不如石墨稳定
B.石墨不如金刚石稳定
C.等质量的石墨和金刚石完全燃烧,石墨放出的热量多
D.等质量的石墨和金刚石完全燃烧,金刚石放出的热量多
13.镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应为Mg+2H++H2O2=Mg2++ 2H2O。关于该电池说法正确的是( )
A.镁合金作为电池的负极,发生还原反应
B.放电时H2O2在正极得电子,被还原
C.负极反应式为:Mg-2e-=Mg2+
D.放电时正极附近溶液酸性增强
12.短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层电子数的3倍。下列说法一定正确的是
A.X和Y都是非金属元素,其中X的最高化合价为+5价
B.元素X可形成化学式为KXO3的盐
C.X与Y所能形成的化合物都是酸性氧化物
D.X的氢化物极易溶于水,可以用来做喷泉实验
11.盐酸与铝粉反应时,下列措施能使最初的反应速率明显加快的是
A.加入少量NaCl固体 B.盐酸的用量增加一倍
C.盐酸的用量减半,浓度加倍 D.向反应混合物中加入少许铜粉
10.下列叙述中不正确的是( )
A.任一主族元素均由非金属元素和金属元素组成
B.第n周期第n主族的元素可能是金属元素,也可能是非金属元素
C.第n周期有(8-n)种非金属元素(1<n≤7,包括稀有气体)
D.同种元素的不同粒子,它们的电子层数可能不同
9.甲、乙、丙为第二、三周期的元素,原子序数依次增大,甲和乙同周期,甲和丙同族,甲、乙原子序数之和与丙的原子序数相等,甲、丙原子的最外层电子数之和与乙原子的电子总数相等。下列说法中,不正确的是
A.乙是地壳中含量最多的元素
B.丙的氢化物比甲的氢化物热稳定性弱
C.乙与丙形成的化合物可制作光导纤维
D.甲、乙两种元素形成的化合物一定是离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com