
题目列表(包括答案和解析)
1.下列各反应中,能说明浓H2SO4既有氧化性又有酸性的是
( )
A.S+2H2SO4(浓)△3SO2↑+2H2O
B.NaCl(s)+H2SO4(浓)△NaHSO4+HCl↑
C.2FeO+4H2SO4(浓)===Fe2(SO4)3+SO2↑+4H2O
D.CuO+H2SO4(浓)===CuSO4+H2O
[答案]C
[解析]浓H2SO4除具有酸性外,还具有以下三大特性:①氧化性;②吸水性;③脱水性。与S反应表现了它的强氧化性,与NaCl(固体)反应表现出强酸性和它的稳定性,与CuO反应时只表现出它的酸性,只有和FeO反应才表现出它的氧化性和酸性。
4.4.2硫酸
17.为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
如图连接好装置,向烧杯中加入25 mL 1 mol/L的Ba(OH)2溶液和2滴酚酞试剂,再一边不断地滴加1 mol/L的H2SO4溶液,并轻轻振荡。试完成下列内容:
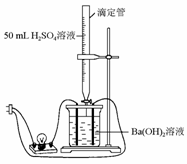
(1)实验现象及分析:①溶液颜色变化为__________,
原因____________________________________。
②灯泡亮度变化:____________________________,
原因____________________________________。
③溶液变浑浊,原因________________________________________________。
(2)实验结论:稀H2SO4与Ba(OH)2溶液反应的实质是______________________(可用离子方程式解释)。
[答案](1)①由红色逐渐变为浅红,最后颜色褪去
Ba(OH)2电离出的OH-与H2SO4电离出的H+中和生成H2O,使烧杯中的c(OH-)减小,红色逐渐褪去
②随H2SO4溶液的不断加入,呈现由明到暗以至熄灭,再逐渐变亮 开始时,溶液中的离子浓度逐渐变小,故灯泡变暗,当烧杯中的Ba(OH)2完全反应后再加H2SO4,离子浓度又变大,灯泡又变亮
③Ba2+与SO结合生成了BaSO4沉淀
(2)2H++SO+Ba2++2OH-===BaSO4↓+2H2O
16.(1)根据下列离子方程式,写出相应的化学方程式。
①Ca2++CO===CaCO3↓;
__________________________________。
②OH-+H+===H2O;
__________________________________。
③CO+2H+===H2O+CO2↑;
__________________________________。
(2)完成离子反应,然后改写成化学反应方程式。
①__________+Ag+===__________+Ag;
______________________________________。
②Fe2O3+__________===Fe3++__________;
______________________________________。
③CaCO3+______===CO2↑+______+______;
______________________________________。
[答案](1)①CaCl2+Na2CO3===CaCO3↓+2NaCl
②HCl+NaOH===NaCl+H2O
③Na2CO3+2HCl===2NaCl+H2O+CO2↑
(2)①Cu+2Ag+===Cu2++2Ag
Cu+2AgNO3===Cu(NO3)2+2Ag
②Fe2O3+6H+===2Fe3++3H2O
Fe2O3+6HCl===2FeCl3+3H2O
③CaCO3+2H+===CO2↑+Ca2++H2O
CaCO3+2HCl===CaCl2+H2O+CO2↑
(或其它合理答案)
15.在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为:A+B产生无色气体;B+C产生白色沉淀;A+D产生白色沉淀;A+C无明显变化。
(1)由此推出各试剂瓶所盛的试剂为(填化学式):
A________,B________,C________,D________。
(2)A+B反应的离子方程式________________。
(3)A+D反应的离子方程式________________。
[答案](1)HCl Na2CO3 BaCl2 AgNO3
(2)CO+2H+===CO2↑+H2O
(3)Ag++Cl-===AgCl↓
[解析]由两两混合实验现象可知:试剂A与其他试剂混合时产生的现象最有特征:与B产生无色气体,与D生成白色沉定,与C无明显现象,由此推知A为盐酸,B为Na2CO3,D为AgNO3,则C为BaCl2,用B+C产生白色沉淀进行验证,可知上述推断完全正确。
14.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)∶试剂__________,
离子方程式为:__________________________________。
(2)O2(CO2):试剂__________________,
离子方程式为:______________________________。
(3)SO(CO)∶试剂____________,
离子方程式为:________________________________。
[答案](1)BaCO3 BaCO3+2H+===Ba2++H2O+CO2↑
(2)NaOH溶液 2OH-+CO2===CO+H2O
(3)稀硫酸 CO+2H+===H2O+CO2↑
13.写出下列反应的离子方程式:
(1)向澄清石灰水中通CO2产生沉淀;
(2)澄清石灰水与稀盐酸反应;
(3)用稀硫酸除去铁锈(Fe2O3·nH2O);
(4)铝片溶于稀硫酸;
(5)锌片放入硫酸铜溶液中;
(6)SiO2与NaOH溶液反应。
[答案](1)Ca2++2OH-+CO2===CaCO3↓+H2O;
(2)OH-+H+===H2O;
(3)Fe2O3·nH2O+6H+===2Fe3++(n+3)H2O;
(4)2Al+6H+===2Al3++3H2↑;
(5)Zn+Cu2+===Cu+Zn2+;
(6)SiO2+2OH-===SiO+H2O。
12.仔细分析下图中的实验:
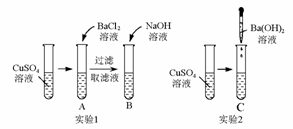
A、B、C试管中的现象如下表所示:
|
A |
B |
C |
|
产生白色沉定, 溶液仍为蓝色 |
产生蓝色沉定, 溶液变为无色 |
产生蓝色沉淀, 溶液为无色 |
写出A、B、C试管中发生反应的离子方程式:
A.____________________________________;
B.____________________________________;
C.____________________________________。
[答案]SO+Ba2+===BaSO4↓
Cu2++2OH-===Cu(OH)2↓
SO+Cu2++Ba2++2OH-===BaSO4↓+Cu(OH)2↓
11.溶液中可能有SO、CO、Cl-、NO等阴离子中的一种或几种,回答下列问题:
(1)当溶液中有大量H+存在时,则溶液中不可能有__________离子。
(2)当溶液中有大量Ba2+存在时,则溶液中不可能有__________离子。
(3)当溶液中有Ag+存在时,则溶液中不可能有__________离子。
[答案](1)CO (2)SO、CO (3)SO、CO、Cl-
10.能正确表示下列化学反应的离子方程式的是
( )
A.氢氧化钡溶液与盐酸的反应:OH-+H+===H2O
B.足量CO2通入澄清石灰水中:
Ca(OH)2+CO2===CaCO3↓+H2O
C.铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D.碳酸钙溶于稀盐酸中:CO+2H+===H2O+CO2↑
[答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com