
题目列表(包括答案和解析)
4.2 g 0.3 mol n2 V2
经分析可知,4.2 g硅与0.3 mol NaOH恰好完全反应,则:
==
n2=0.15 mol V2=6.72 L
所以,产生的氢气在标准状况下的体积为
6.9 g n1 V1
==
n1=0.3 mol V1=3.36 L
Si + 2NaOH+H2O===Na2SiO3+2H2↑
28 g 2 mol 1 mol 2×22.4 L
13.已知硅可与碱溶液发生下列反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。现将6.9 g钠和4.2 g硅同时投入足量水中充分反应后,测得溶液体积为500 mL,求产生的氢气在标准状况下的体积为多少升?所得溶液的物质的量浓度为多少?
[答案]10.08 L,0.3 mol·L-1
[解析]设6.9 g金属钠与水反应放出的氢气体积为V1,生成的NaOH的物质的量为n1,4.2 g硅与氢氧化钠反应生成的氢气体积为V2,生成的Na2SiO3的物质的量为n2。
2Na + 2H2O===2NaOH + H2↑
2×23 g 2 mol 22.4 L
12.有A、B、C、D四种含硅元素的物质,它们能发生如下反应:
(1)C与烧碱反应生成A和水;
(2)A溶液与钙盐溶液反应生成白色沉淀D;
(3)B在空气中燃烧生成C;
(4)C在高温下与碳反应生成单质B。
根据上述变化,写出A、B、C、D的化学式:
A__________,B__________,C__________,D__________。
[答案]Na2SiO3 Si SiO2 CaSiO3
[解析]单质B应为硅,在空气中燃烧产物C为SiO2,SiO2与烧碱反应生成Na2SiO3和水,Na2SiO3和钙盐生成的沉淀D为CaSiO3。
11.用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是______________________。
(2)光导纤维的主要成分是__________。
(3)目前应用最多的太阳能电池的光电转化材料是__________。
[答案](1)硅 (2)二氧化硅 (3)硅
10.A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请填空:
(1)形成单质A的原子的结构示意图为__________,它是最高化合价为__________。
(2)B的化学式(分子式)为__________,B和碳反应生成A和E的化学方程式是____________________________________________________________________。
(3)C的化学式(分子式)为__________,D的化学式(分子式)为______________。
[答案](1) 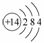 +4
+4
(2)SiO2 SiO2+2C高温Si+2CO↑
(3)CaSiO3 Na2SiO3
[解析]A为地壳中含量仅次于氧的非金属元素的单质,可知A为Si。B+碳高温硅+E,B又能与CaO、NaOH分别反应,可推出B为SiO2,E为CO,C为CaSiO3,D为Na2SiO3。
9.根据下图中所表示的变化关系
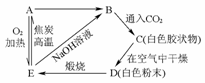
(1)写出各物质的化学式。
A是__________,B是__________,C是__________,D是__________,E是__________。
(2)写出下列反应的化学方程式:
A→B__________________________;
B→C__________________________;
D→E__________________________;
E→A__________________________。
[答案](1)A:Si B:Na2SiO3 C:H4SiO4 D:H2SiO3 E:SiO2
(2)A→B
Si+2NaOH+H2O===Na2SiO3+2H2↑
B→C
Na2SiO3+CO2+2H2O===Na2CO3+H4SiO4↓
D→E H2SiO3△H2O↑+SiO2
E→A SiO2+2C高温Si+2CO↑
[解析]从A为硅突破。
8.下列物品或设备:①水泥路桥,②门窗玻璃,③水晶镜片,④石英钟表,⑤玛瑙手镯,⑥硅太阳能电池,⑦光导纤维,⑧计算机芯片。所用材料为SiO2或要用到SiO2的是
( )
A.①②③④⑤⑦ B.全部
C.⑥⑧ D.①②⑦⑧
[答案]A
[解析]⑥、⑧用到的材料是Si而不是SiO2,其余都用到SiO2。
7.硅被誉为无机非金属材料的主角。下列物品用到硅单质的
( )
A.陶瓷餐具 B.石英钟表
C.计算机芯片 D.光导纤维
[答案]C
6.已知Si+2NaOH+H2O===Na2SiO3+2H2↑,
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
有一根粗铝含铁和硅两种杂质,取两份等质量的样品分别投入足量的稀盐酸和稀NaOH溶液中,放出等质量的H2,则该粗铝中铁和硅的关系是
( )
①物质的量之比为1∶2 ②物质的量之比是3∶1
③质量之比是2∶1 ④质量之比是4∶1
A.②④ B.②③
C.①④ D.只有④
[答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com