
题目列表(包括答案和解析)
5.(2010年石家庄模拟)下列有关实验操作不正确的是
( )
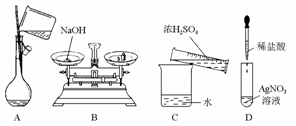
[答案]BC
[解析]NaOH固体不应直接在托盘上称量;浓H2SO4的稀释应将浓H2SO4沿着烧杯内壁缓缓加入,并不断用玻璃棒搅拌。
4.配制100 mL 1.0 mol/L Na2CO3溶液,下列操作正确的是
( )
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
[答案]D
3.将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1CaCl2溶液混合后,若溶液的总体积为二者体积之和,则混合溶液中c(Cl-)为
( )
A.1 mol·L-1 B.0.55 mol·L-1
C.0.67 mol·L-1 D.2 mol·L-1
[答案]B
2.下列溶液中,物质的量浓度为1 mol·L-1的是
( )
A.将40 g NaOH溶于1 L水所得的溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol·L-1 NaOH溶液100 mL加热蒸发掉50 g水的溶液
D.含K+ 2 mol的K2SO4溶液
[答案]B
[解析]要想知道溶质的物质的量浓度必须要确定溶质的物质的量与溶液的体积。A、C、D三项溶液的体积不能确定;B项中SO3溶于H2O生成H2SO4恰好为1 mol,溶液体积为1 L,故c(H2SO4)=1 mol/L。
1.2 g NaOH固体溶于水配成250 mL溶液,取出其中的50 mL,该50 mL NaOH溶液的物质的量浓度为
( )
A.0.04 mol/L B.0.2 mol/L
C.1 mo/L D.2 mol/L
[答案]B
[解析]因为n===0.05 mol,c(NaOH)=0.2 mol/L,由于溶液是均一稳定的,取出其中的50 mL,物质的量浓度仍为0.2 mol/L。
1.2.3物质的量在化学实验中的应用
16.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HClSiHCl3+H2
③SiHCl3与过量H2在1 000 ℃-1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为:________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
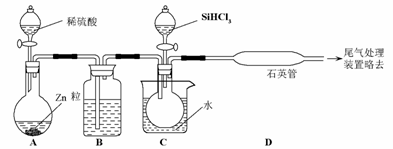
①装置B中的试剂是__________,装置C中的烧瓶需要加热,其目的是:____________。
②反应一段时间后,装置D中观察到的现象是__________,装置D不能采用普通玻璃管的原因是__________________,装置D中发生反应的化学方程式为___________________。
③为保证制备纯硅实验的成功,操作的关键是检验实验装置的气密性,控制好反应温度以及__________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是__________。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
[答案](1)SiO2+2CSi+2CO↑
(2)分馏(或蒸馏)
(3)①浓硫酸 使滴入烧瓶中的SiHCl3汽化 ②有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl3+H2Si+3HCl ③排尽装置中的空气 ④b、d
15.A是一种常见单质,A、B、C、D之间的转化关系如图,C是一种难溶性物质。
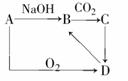
(1)若A是一种金属,则A是__________,试写出由A?B的离子方程式_____________。
(2)若A是一种非金属,则A__________,试写出由A?B的离子方程式____________。
(3)现将一定量的A溶解于NaOH溶液中,但通入CO2时却没有立即产生沉淀,你认为最可能的原因是________________________________(用离子方程式表示)。
(4)以下是判断A是金属还是非金属的实验方案,你认为合理的是__________,最简便的是__________。
A.将A加入到盐酸中,观察是否有气泡产生
B.一定量的A在空气中充分加热,称量加热前后的质量变化
C.将一定量的A溶解于足量的NaOH溶液中,测定生成气体的体积
D.常温下将一定量的A加入到浓硝酸中,测定剩余固体的质量
[答案](1)Al 2Al+2H2O+2OH-===2AlO+3H2?
(2)Si Si+2OH-+H2O===SiO+2H2?
(3)CO2+2OH-===CO+H2O
(4)A、B、C A
[解析]从框图可以看出,D是一种氧化物,B是一种钠盐,通入CO2能产生沉淀的钠盐主要有偏铝酸盐和硅酸盐,这样可初步推断A可能是Si或Al;(3)通入CO2未产生沉淀,最可能的原因就是NaOH是过量的,通入的CO2与NaOH发生了反应;(4)A、B、C项均可区别Si和Al,但D项中Al与浓硝酸混合,常温下钝化。从操作上来说A项最简便。
14.有一种矿石,经测定镁、硅、氧元素的质量比为12∶7∶16。
(1)用盐的组成表示其化学式__________________________________。
(2)用氧化物的组成表示其化学式__________________________。
(3)该矿石的成分属于______________________________(填物质的分类)。
[答案](1)Mg2SiO4 (2)2MgO·SiO2 (3)硅酸盐
[解析]该矿石中镁、硅、氧三种元素的物质的量比为:n(Mg)∶n(Si)∶n(O)=∶∶=2∶1∶4
所以其化学式为Mg2SiO4。
3.36 L+6.72 L=10.08 L,
所得溶液的物质的量浓度为=0.3 mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com