
题目列表(包括答案和解析)
4.只含一种杂质的不纯氯化铜13.5 g,当与足量的硝酸银溶液反应时,生成29 g AgCl沉淀,则氯化铜粉末中的杂质可能是
( )
A.FeCl3 B.CaCl2
C.ZnCl2 D.BaCl2
[答案]AB
[解析]这道题用数学中的极值法求解。设13.5 g为纯净的CuCl2。
CuCl2+2AgNO3===2AgCl↓+Cu(NO3)2
135 2×143.5
3.当不慎有大量Cl2逸出时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,该物质最适宜选用的是
( )
A.NaOH B.NaCl
C.KBr D.Na2CO3
[答案]D
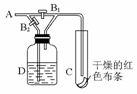
2.如下图,从A处通入Cl2,关闭B1阀,打开B2阀时,C处的红色布条上看不到明显现象;当关闭B2阀,打开B1阀后,C处红布条逐渐褪色。则D瓶中装的是
( )
A.浓H2SO4 B.NaOH溶液
C.H2O D.饱和NaCl溶液
[答案]AB
[解析]应先判断A处通入Cl2是否带有水蒸气。根据B1阀打开时,C条红色布条褪色,说明A处Cl2为潮湿的,潮湿的Cl2在B1阀关闭时通过D,看不到C处红布条有明显变化,说明D处溶液吸收了氯气或者是吸收了潮湿氯气中的水蒸气。故应选A、B。
1.漂白粉在空气中放置易失效的主要原因是
( )
A.Ca(ClO)2不稳定,易分解
B.CaCl2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应
D.Ca(ClO)2跟空气中的CO2反应
[答案]C
[解析]漂白粉在空气中放置易失效的主要原因是,因为次氯酸的酸性弱于碳酸,碳酸可以与Ca(ClO)2反应生成HClO,次氯酸不稳定,在光的作用下易分解,使漂白粉失效,有关的化学方程式为:
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
2HClO光照2HCl+O2↑
4.2.2氯气、氯离子的检验和卤素单质的性质
19.8.7 g MnO2和120 mL 10 mol·L-1的盐酸作用制取Cl2,把完全反应后的溶液稀释至1.0L后取出20 mL,在这20 mL的溶液中加入足量的AgNO3溶液,可得AgCl多少克?
[答案]2.87 g
[解析]根据MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O可判断浓盐酸过量,8.7 g MnO2完全反应,生成氯气为0.1 mol。则溶液中的n(Cl-)=10 mol·L-1×0.12 L-0.1 mol×2=1 mol,则从1.0 L取出的20 mL中含有n(Cl-)=1 mol×=0.02 mol,n(AgCl)=n(Cl-)=0.02 mol,m(AgCl)=0.02 mol×143.5 g·mol-1=2.87 g。
18.一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.2 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 mol。
(1)原NaOH溶液的质量分数为__________。
(2)所得溶液中Cl-的物质的量为__________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=__________。
[答案](1)10.7% (2)0.25 (3)3∶2
[解析]氯气分为两部分,一部分首先和氢气反应生成氯化氢,剩余的另一部分和氢氧化钠反应生成NaClO和NaCl
(1)n(NaOH)=0.100 L×3.00 mol·L-1=0.30 mol,m(NaOH)=0.30 mol×40 g·mol-1=12.00 g
m(aq)=100 mL×1.12 g·mL-1=112 g
w(NaOH)=×100%=10.7%。
(2)根据Cl2+2NaOH===NaCl+NaClO+H2O,因为NaClO的物质的量为0.050 mol,所以NaCl的物质的量也为0.050 mol;所以和氯气反应的n(NaOH)=2n(NaClO)=2×0.050 mol=0.10 mol;
和盐酸反应的n(NaOH)=0.30 mol-0.10 mol=0.20 mol
n(Cl-)=0.20 mol+0.050 mol=0.25 mol
(3)n(H2)=n(HCl)/2=1/2×0.20 mol=0.10 mol
n(Cl2)=n(H2)+n(NaClO)=0.10 mol+0.050 mol=0.15 mol
所以,n(Cl2)∶n(H2)=0.15 mol∶0.10 mol=3∶2。
17.根据舍勒研究氯气的史实,人们经过大量的研究,弄清其反应原理为:MnO2+4HCl(浓)MnCl2+H2O+Cl2↑。
请你分析该反应的氧化剂________,还原剂________发生反应时氧化剂与还原剂的物质的量之比为________。
[答案]MnO2 HCl 1∶2
[解析]根据化合价变化可知氧化剂为MnO2,还原剂为HCl,但4 mol HCl只有2 mol HCl作还原剂。
16.氯水中含有的各种微粒中:
(1)使氯水呈黄绿色的是(用化学式或离子符号填写,下同)__________;
(2)能使硝酸银溶液产生白色沉淀的是__________;
(3)能使石蕊显红色的是__________;
(4)能使有色布条褪色的是__________;
(5)能使无水硫酸铜变蓝色的是__________;
(6)能使NaHCO3溶液产生气体的是__________。
[答案](1)Cl2 (2)Cl- (3)H+ (4)HClO
(5)H2O (6)H+
15.(1)对于下列反应的现象,用以下答案的编号加以回答。
A.白烟 B.白雾 C.白色烟雾 D.棕黄色烟
E.棕黄色烟雾
①灼热的铜丝在氯气中燃烧,集气瓶内产生( );
②氢气在氯气中燃烧,集气瓶口有( );
③红磷在氯气中燃烧,集气瓶内产生大量的( );
④金属钠在氯气中燃烧,集气瓶口产生大量的( )。
(2)指出下列诗词各句中所出现的“烟”字,哪些指的是真正的“烟”( )。
A.大漠孤烟直,长河落日圆
B.暖暖远人村,依依墟里烟
C.南朝四百八十寺,多少楼台烟雨中
D.谈笑间,樯橹灰飞烟灭
E.碧云天,黄叶地;秋色连波,波上寒烟翠
F.一川烟草,满城风絮,梅子黄时雨
[答案](1)①D ②B ③C ④A (2)A、B、D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com