
题目列表(包括答案和解析)
7.用下列方法均可制得氧气:
(1)2KClO3MnO2△2KCl+3O2↑
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)2HgO2Hg+O2↑
(4)2KMnO4K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
( )
A.3∶2∶1∶4 B.1∶1∶1∶1
C.2∶1∶2∶2 D.1∶2∶1∶1
[答案]C
[解析]只有(2)中O2是由变化而来,其他三个都是由变化而来
6.下列对氧化还原反应所标出的电子转移情况中没有错误的是
( )
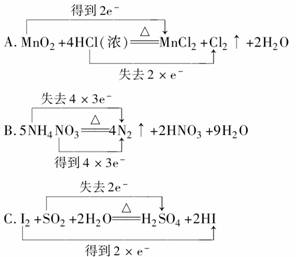
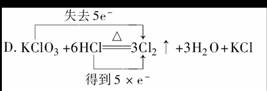
[答案]AC
[解析]B中NH中N的化合价是-3价升高到N2中的0价失去5×3e-,而NO中N的化合价从+5价降低到N2中的零价,得3×5e-,故B错,D中KClO3应得电子,而HCl应失去电子,故D错,A、C分析正确。
5.在反应2H2S+SO2===3S↓+2H2O中,氧化产物和还原产物的质量之比为
( )
A.2∶1 B.8∶3
C.1∶2 D.3∶8
[答案]A
[解析]反应中均是硫元素的化合价发生变化,所以S既是氧化产物又是还原产物。二者的质量之比即为物质的量之比。2H2 ―→2化合价升高,被氧化,其相应生成物为氧化产物;1O2―→1S化合价降低,被还原,其相应生成物为还原产物。
注意题中所问的氧化产物与还原产物的顺序,即还原剂被氧化发生氧化反应,生成氧化产物,氧化剂被还原,发生还原反应,生成还原产物。
4.根据下列反应判断有关物质还原性由强到弱的顺序是
( )
H2SO3+I2+H2O===2HI+H2SO4
2FeCl3+2HI===2FeCl2+2HCl+I2
3FeCl2+4HNO3===2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
[答案]A
[解析]先确定各反应的还原剂(分别为H2SO3、HI、FeCl2)和还原产物(分别为HI、FeCl2、NO),根据还原性:还原剂>还原产物,故有H2SO3>HI,HI>FeCl2,FeCl2>NO,归纳起来,答案为A。
3.菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是
( )
A.在该反应中维生素C作催化剂
B.由上述信息可推知砒霜中含有的砷是+3价
C.因为河虾中含有砷元素,所以不能食用
D.上述反应中维生素C作氧化剂
[答案]B
2.下列反应中,氧化产物中产生的单质属于有色单质的是
( )
A.CuCl2+Fe===FeCl2+Cu B.Zn+H2SO4===ZnSO4+H2↑
C.2H2S+O2===2S+2H2O D.2KClO3MnO2△2KCl+3O2↑
[答案]C
[解析]首先判断各反应中的氧化产物,根据反应物中的某元素发生氧化反应后对应的生成物为氧化产物原则分析可知,A项中的氧化产物是 FeCl2,B项中氧化产物是 ZnSO4,C项中氧化产物是S,D项中氧化产物是O2,然后再判断氧化产物是有色单质的是C项,因为A、B项的氧化产物是化合物,D项的氧化产物是无色的氧气。
1.(2010年启东高一检测)吸进人体的氧有2%转化为氧化性极强的活性氧,这些活性氧加速人体衰老,被称为“生命杀手”,科学家试用Na2SeO3消除人体内的活性氧,则Na2SeO3的作用是
( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.以上均不是
[答案]B
2.3.2氧化剂和还原剂
16.金属加工后的废弃液中含2%-5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废弃液,使 NaNO2溶液转化为无毒物质。该反应分两步进行。第一步:NaNO2+NH4Cl===NaCl+NH4NO2,第二步:NH4NO2===N2↑+2H2O。
(1)第一步属于__________反应,第二步属于__________反应。(填基本反应类型)
(2)第__________步反应是氧化还原反应,__________被氧化,__________被还原。
[答案](1)复分解;分解;(2)二;-3价N元素;+3价N元素
[解析](1)第一步两种反应交换成分,是复分解反应;第二步属于分解反应。
(2)第二步是有单质生成的分解反应,是氧化还原反应。铵根(NH)中-3价的N元素升高到N2中的0价,被氧化;亚硝酸根(NO)中+3价的N元素降低到N2中的0价,被还原。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com