
题目列表(包括答案和解析)
6、下列说法中正确的是
A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应的基础是氧化还原反应
D.铅蓄电池放电的时候正极是Pb负极是PbO2
5、下列叙述正确的是
A.两个非金属原子间不可能形成离子键 B.非金属元素不可能形成离子化合物
C.离子化合物中不可能有共价键 D.共价化合物中可能有离子键
4、迄今为止合成的最重的元素是112号元素,它是用 高能原子轰击 的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子( )的同时向外释放出一个中子。下列说法错误的是
A.112号元素是金属元素 B.112号元素位于第七周期,是主族元素
C. 原子中子数为165 D.112号元素为放射性元素
3、已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
 D.X和Y的总能量一定低于M和N的总能量
D.X和Y的总能量一定低于M和N的总能量
2、用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是
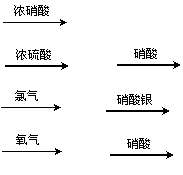
A.铜 硝酸铜
B.铜 硫酸铜 硝酸铜
C.铜 氯化铜 硝酸铜
D.铜 氧化铜 硝酸铜
1、检验氨气可以用
A.湿润的红色石蕊试纸 B.干燥的红色石蕊试纸
C.干燥的蓝色石蕊试纸 D.湿润的蓝色石蕊试纸
23.( 7分)1体积某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(在同温同压下测定),0.1 mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39 g,则该烃的分子式为?
郑州一中2011年高一下学期期末考前模拟
22.计算填空(12分)
(1)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a= ,b= ;
②2S内B的反应速率= 。
(2)(4分)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:
③有 个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
(3)(2分)将2.3g金属钠放入足量的mg重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是 (用含m的代数式表示)。
21. (7分) A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
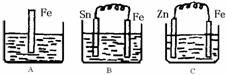
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A ;B ;C 。
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为: (填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 (填写序号)。
20. (8分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
 (1)该反应的化学方程式为
。
(1)该反应的化学方程式为
。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ____________(填“增大”“减小”或“相等”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com