
题目列表(包括答案和解析)
9、X、Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
(A) n+11 (B) n-6 (C) n+3 (D) n-5 10、A、B、C、是周期表中相邻的三种元素,且相对原子质量逐渐增大,A和B同周期,B和C同主族,三种元素原子最外层电子数总和为17,质子总和为31,A、B、C三种元素是( )
(A) Mg Al B (B) N O S (C) Li Be Mg (D) O F Cl
8、 下列各分子中,所有原子都满足最外层8电子结构的是( )
下列各分子中,所有原子都满足最外层8电子结构的是( )
(A) PCl3 (B) BF3 (C) H2O (D) PCl5
3、下列与F-具有相同质子数和电子数的微粒是( )
(A) C1- (B) Na+ (C) OH- (D) O2-
2、对符号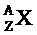 的理解正确的是:( )
的理解正确的是:( )
(A) X元素的-种原子的相对原子质量是A
(B) X元素的一种原子的质子数是A
(C) X元素的一种原子的质量数是Z
(D) X元素的一种原子的原子核内中子数是A-Z
1、元素性质呈周期性变化的根本原因是( )
(A) 相对原子质量逐渐增大 (B) 核电荷数逐渐增大
(C) 核外电子排布呈周期性变化 (D) 元素化合价呈周期性变化
22、(8分)将32.64g铜与140mL一定浓度的硝酸恰好完全反应,产生的NO和NO2
(不考虑N2 O4)混合气体在标准状况下的体积为11.2L。(计算结果均取小数点后2位)
(1)铜的物质的量为
(2)NO 的体积为
(3)原硝酸的浓度为
揭阳第一中学2010-2011学年度第二学期期中考试
21、(12分)乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。请回答:
(1) (6分)乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 ;乙烯在一定条件下
发生加聚反应的化学方程式为 。
(2) (6分)此外,乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
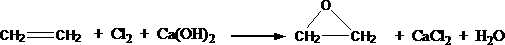 [工艺一]:
[工艺一]:
(环氧乙烷)
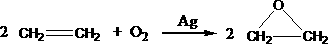 [工艺二]:
[工艺二]:
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率 100%(填“>”、“=”、“<”。下同);工艺二的原子利用率为 100%。因此,在实际生产中,应采用工艺 更环保、更经济。
20、(17分)
(Ⅰ)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:① 元素周期表中,Z与Y相邻,Z与W也相邻; ② Y、Z和W三种元素的原子最外层电子数之和为17。 请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”) ,理由是 。
(2)Y是 、Z是 、W是 (填元素符号)。
(3)X、Y、Z和W可组成一种化合物,其原子个数之比为8﹕2﹕4﹕1。写出该化合物的名称及化学式 ,该化合物中的化学键有 (填“离子键”、“极性键”或“非极性键”)。
(Ⅱ)A、B、C、D是4种短周期元素,它们的原子序数依次增大,其中A、C及D、B分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子中质子数和的2倍,这4种元素的单质中有2种气体,2种固体。
(1)写出元素名称:A___ __,C___ ___。
(2)写出2种均含A、B、C、D四种元素的化合物相互反应逸出气体的化学方程式:
_ 。
(3)用A元素的单质和B元素的单质可以制成电池,电池中装有浓KOH溶液,用多种的惰性电极浸入KOH中,两极均有特制的可以防止气体透过的隔膜,在一极通入A的单质,另一极通人B的单质,通入B单质的一极电极反应方程式是:
。
19、(11分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1) 哪一时间段(填0-1、1-2、2-3、3-4、4-5 min)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是
(3)第2 ~ 3分钟时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液
D.CuSO4溶液 E.Na2CO3溶液 F.CH3COONa溶液
18、关于右图所示的原电池,下列说法正确的是
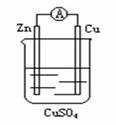 A.电子从锌电极通过电流表流向铜电极
A.电子从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13g Zn溶解时,电路中就有0.4 mol电子通过
D.铜电极做正极发生的电极反应为2H++2e-===H2↑
第Ⅱ卷(非选择题,共48分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com