
题目列表(包括答案和解析)
3.下列强碱碱性介于KOH和Mg(OH)2之间的是( )
A. NaOH B.Al(OH)3 C. LiOH D.RbOH
2.下列试剂能贮存在磨口玻璃塞的试剂瓶里的是( ) A.HF溶液 B.KOH溶液 C.Na2SiO3溶液 D.盐酸
1.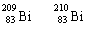 铋(Bi)在医药方面有重要应用。 下列关于 和 的说法正确的是( )
铋(Bi)在医药方面有重要应用。 下列关于 和 的说法正确的是( )
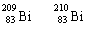
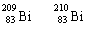
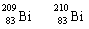
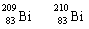 A. 和 都含有83个中子;
A. 和 都含有83个中子;  B. 和 互为同位素
B. 和 互为同位素
C. 和 的核外电子数不同; D. 和 分 别含有126和127个质子
别含有126和127个质子
40、短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
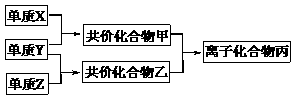
已知:a. 常见双原子单质分子中,X分子含共价键最多。
b. 甲分子含10个电子,乙分子含18个电子。
 (1)X的电子式是
。
(1)X的电子式是
。
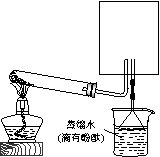
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)____________________。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)____________________________________。
39、已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,Z原子的最外层电子数是其次外层电子数的三倍,X原子和Z原子的最外层电子数之和等于Y原子的电子总数,则:
(1)填写元素名称:X是________,Y是________,Z是________;
(2)由Y和Z组成,且Y和Z的质量比为7︰20的化合物的化学式为________;
(3)X和Z可组成两种化合物,它们的电子式分别为________,________;
(4)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是_____和_____;
(5)X、Y、Z可形成一种盐,此盐中X、Y、Z元素的原子个数比为4﹕2﹕3,该盐的化学式是______,其中包含的化学键是___________________。
38.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分,请依据该表回答问题。
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
H |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
He |
|
2 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)可用于半导体材料的元素是 (填元素符号),它在元素周期表中的位置为 。
(2)第3周期IA族元素的原子结构示意图是 ,该元素与同周期VIIA族元素组成的化合物类型是 。该化合物在生产生活中有广泛用途,请举一例 。
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是 (填化学式,下同);碱性最强的是 ;具有两性的是 ,其与氢氧化钠溶液反应的化学方程式为 。
(4)由H、N、O三种元素组成的离子化合物X,在 210℃时可分解生成N元素的一种气态氧化物Y和水。已知 40 g X完全分解可生成11.2 L(标准状况)Y,则Y的化学式为 。
37、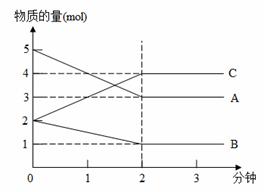 某可逆反应从0-2 分钟进行过程中,在不同反应时间各物质的量变化情况如图所示。则该反应的反应物是____,生成物是_____,化学方程式为_______;
某可逆反应从0-2 分钟进行过程中,在不同反应时间各物质的量变化情况如图所示。则该反应的反应物是____,生成物是_____,化学方程式为_______;
反应开始至2分钟时,能否用C表示反
应速率?__________(若能,算出其反应速
率,若不能,说明原因)_______________。
2分钟后A、B、C各物质的量不再随时间
的变化而变化,说明在这个条件下,反应
已达到了___________状态。
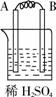
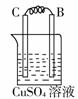
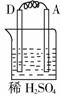
36.由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:
|
装 置 |
 |
 |
 |
|
现
象 |
金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
|
正极反应式 |
|
|
|
|
四种金属活动性由强→弱的顺序 |
|
35、有铜、锌和稀硫酸组成的原电池中,铜是___极,发生___反应,电极反应式是______;锌是__极,发生___反应,电极反应式是______;电子沿导线从___极流向___极(填正、负)。
34.用电子式表示下列化合物的形成过程:
(1)水: ;(2)硫化钠: 。(3)氯化镁: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com