
题目列表(包括答案和解析)
9.下列说法正确的是( )
A. 饱和溶液一定是浓溶液 B. 析出晶体后的溶液一定是饱和溶液
C. 饱和溶液降温后一定有晶体析出 D. 凡是均一的、透明的液体都是溶液
8.将60℃时的硝酸钾饱和溶液降温至20℃,不发生变化的是( )
A. 硝酸钾的溶解度 B. 溶液中的溶质质量 C. 溶液中的溶剂质量 D. 溶液中的溶质质量分数
7.在一个南瓜上挖一个大孔,向其中注入饱和的硫酸钠溶液,一段时间后,将硫酸钠溶液倒出,在相同温度下,发现倒出的溶液还可以溶解少量的硫酸钠,这说明( )
A. 倒出的溶液是饱和溶液 B.倒出的溶液不是饱和溶液 C. 硫酸钠的溶解度增加 D. 硫酸钠的溶解度减小
6.在一定温度下,在下列物质足量混合并充分振荡,其中肯定不能形成饱和溶液的是( )
A. 氯化钠与水 B. 硫酸钡与水 C. 氢氧化钙与水 D. 酒精与水
5.通常情况下,欲将一杯不饱和食盐水变成饱和溶液,最适宜的方法是( )
A. 往食盐水中加入食盐 B. 往食盐水中加入水 C. 往食盐水中加入饱和食盐水 D. 把食盐水放入冰箱中
4.饱和食盐水在室温下露置在空气中一段时间后,有少量的氯化钠固体析出,这是因为( )
A. 氯化钠的溶解度变小 B. 溶液变成了不饱和溶液 C. 溶剂质量变小 D. 溶液中溶质的质量分数变小
3.60℃时,硝酸钾的溶解度为110g。该温度下硝酸钾饱和溶液中有关质量关系正确的是( )
A. 溶质的质量:溶剂的质量=1:10 B. 溶剂的质量:溶液的质量=10:21
C. 溶质的质量:溶剂的质量=11:10 D. 溶液的质量:溶质的质量=21:10
2. 在25℃时,向饱和的澄清石灰水中加入少量的氧化钙.恢复到25℃时,关于该溶液的下列说法正确的是( )
A. 溶质的质量不变 B. 溶质的质量减少 C. 溶质的质量分数减小 D. 溶质的质量分数增大
1. 以下是一些关于溶液的说法:①无色,②混合物,③化合物,④均一的,⑤稳定的,⑥各部分的性质相同。其中正确的是( )
A. ①③④⑤ B. ②④⑤⑥ C. ①②④⑤ D. ①③⑤⑥
2.了解:溶液的概念;溶质,溶剂的判断;饱和溶液与不饱和溶液的概念、判断、转换的方法;溶解度的概念;固体溶解度曲线的应用
① 溶液的概念就是9个字:均一的、稳定的、混合物。溶液不一定是液体的,只要同时满足以上三个条件的物质,都可以认为是溶液。
② 一般简单的判断方法:当固体、气体溶于液体时,固体、气体是溶质,液体是溶剂。两种液体相互溶解时,通常把量多的一种叫做溶剂,量少的一种叫做溶质。当溶液中有水存在的时候,无论水的量有多少,习惯上把水看作溶剂。通常不指明溶剂的溶液,一般指的是水溶液。
在同一个溶液中,溶质可以有多种。特别容易判断错误的是,经过化学反应之后,溶液中溶质的判断。
③ 概念:饱和溶液是指在一定温度下,在一定量的溶剂里,不能再溶解某种物质的溶液。还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
在一定温度下,某溶质的饱和溶液只是说明在该温度下,不能够继续溶解该物质,但还可以溶解其他物质,比如说,在20℃的饱和氯化钠溶液中,不能再继续溶解氯化钠晶体,但还可以溶解硝酸钾固体。
判断:判断是否是饱和溶液的唯一方法:在一定温度下,继续投入该物质,如果不能继续溶解,则说明原溶液是饱和溶液,如果物质的质量减少,则说明原溶液是不饱和溶液。
当溶液中出现有固体时,则该溶液一定是该温度下,该固体的饱和溶液。
转换:饱和溶液与不饱和溶液的相互转换:

改变溶解度,实际一般就是指改变温度,但具体是升高温度还是降低温度,与具体物质溶解度曲线有
④ 溶解度曲线的意义:
(1)表示某物质在相应温度下的溶解度 (2)表示某物质在不同温度下的溶解度
(3)表示不同物质在同一温度下的溶解度 (4)表示某物质的溶解度随温度变化的趋势
⑤ 溶解度曲线的应用:
(1) 判断某一种物质在不同温度下的溶解度大小
(2) 比较同一温度下,不同物质溶解度的大小
(3) 判断不同物质溶解度受温度影响变化趋势
(4) 确定混合物的分离、提纯的方法
(5) 判断析出晶体量的多少
⑥ 溶液中有关的计算公式:
(1)溶解度的计算公式:溶解度= (饱和溶液中)
(饱和溶液中)
(2)溶液中溶质的质量分数=
(3)饱和溶液的质量分数=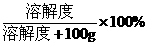
典型习题:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com