
题目列表(包括答案和解析)
29.(10分)(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O===4Al(OH) 3,负极为 ,负极发生 反应(填“氧化”或“还原”),负极反应 ;正极为铂网, (填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向 (填“正极”或“负极”)。
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2===2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应为:2H2-4e-===4H+,则正极反应为 ;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-==4OH-,则负极反应为: 。
|
|
 (3)蓄电池Pb+PbO2+2H2SO4 2PbSO4+2H2O放电时,正极电极反应式 ,当电
(3)蓄电池Pb+PbO2+2H2SO4 2PbSO4+2H2O放电时,正极电极反应式 ,当电
路中通过0.5mol电子时,消耗H2SO4的物质的量 ,负极增重 g

|
|
 2NO2 (g),如图所示。
2NO2 (g),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量
随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆)
|
|
|
中v(NO2)=0.3 mol·L-1·min-1,乙中v (N2O4)=0.2 mol·L-1·min-1,则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,
该反应达最大限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
(5)下列描述能表示反应达平衡状态的是 。
A.容器中X与Y的物质的量相等 B.容器内气体的颜色不再改变
C.容器的压强保持一定 D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1 mol N2O4完全转化为2 mol NO2 (g)时吸收QKJ的热量,在一密闭容器中充入2 mol NO2 (g),容器内温度 (升高、降低或不变)。达到反应限度时反应产生的热量
QKJ(大于、小于或等于)。
绵阳中学高2013级第二学期半期考试
28.(10分)有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图 。
(2)A、E氢化物的稳定性比较 。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序 (用离子符号表示)
(4)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子反应方程式:
。
(5)在一种含有A元素的有18个电子的化合物和稀盐酸的混合物中加入铜片,溶液变为蓝色,写出该反应的离子反应方程式 。
(6)写出实验室制E的氢化物的化学反应方程式 。
27、(10分)从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12∶1,B的相对分子质量为78。回答下列问题:
(1)A的电子式 ,A的结构简式 。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式 ,反应类型 。
(3)在碘水中加入B振荡静置后的现象 。
(4)B与浓H2SO4与浓HNO3在50-600C反应的化学反应方程式 ,反应类型 。
(5)等质量的A、B完全燃烧时消耗O2的物质的量 (填“A>B”或“A<B”或“A=B”)
26.(10分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置 。
(2)上述五种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物为 (填化学式),含有的化学键类型为 。
(5)F与G形成的最简单的化合物的电子式 ,该分子的空间构型为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)在有饱和食盐水的水槽中,用一倒扣在水槽中的试管用排饱和食盐水法先后收集等体积的GF4和D的单质气体,在光照条件下可观察到水槽中有晶体析出,试管内气体颜色逐渐变浅,液面上升, , 等现象产生
25.在4L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)  2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol/L,下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol/L,下列判断正确的是( )
A.x=1 B.B的转化率为20%
C.平衡时A的浓度为1.50 mol/L
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
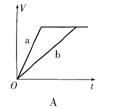
24.等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )



23.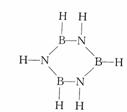 环状结构(BHNH)3称为无机苯,它和苯是等电子体,
环状结构(BHNH)3称为无机苯,它和苯是等电子体,
(BHNH)3的结构简式为:
无机苯的二氯代物的同分异构体共有( )
A.5种 B.4种 C.3种 D.2种
22.在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g) C(g)+D(g),能表明反应已达平衡状态的是( )
C(g)+D(g),能表明反应已达平衡状态的是( )
A.混合气体的压强不变 B.混合气体的密度不变
C.单位时间内生成n molC的同时生成n mol D D.气体总物质的量不变
21. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化( )
A.杠杆为导体和绝缘体时,均为A端高、B端低
B.杠杆为导体和绝缘体时,均为A端低、B端高
C.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
D.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高
20.微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,电池总反应式为Ag2O+Zn===2Ag+ZnO。根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com